题目内容
(12分)某同学准备用CuSO4·5H2O配制480 mL 1 mol/L的溶液。
⑴该同学选用的容量瓶容积的规格是 mL;
⑵玻璃棒在该实验中有重 要的用途,分别是 和 ;
要的用途,分别是 和 ;
⑶配制好的溶液呈 色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
⑷物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶洗净后未干燥,残留少量水,则所配制的溶 液浓度将
液浓度将  ;
;
②定容时,若眼睛俯视,则所配制的溶液浓度将 。
⑴该同学选用的容量瓶容积的规格是 mL;
⑵玻璃棒在该实验中有重
 要的用途,分别是 和 ;
要的用途,分别是 和 ;⑶配制好的溶液呈
 色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。| 溶质 | 加入试剂 | 离子方程式 |
| Cu2+ | | |
| SO42- | | |
①若容量瓶洗净后未干燥,残留少量水,则所配制的溶
 液浓度将
液浓度将  ;
;②定容时,若眼睛俯视,则所配制的溶液浓度将 。
⑴500 ⑵搅拌,加速固体溶解和引流液体
⑶
⑷①无影响 ②偏高
⑶
| 溶质 | 加入试剂 | 离子方程式 |
| Cu2+ | NaOH | Cu2+ +2OH-=" " Cu(OH)2↓ |
| SO42- | BaCl2 | Ba2+ + SO42-= BaSO4↓ |
略

练习册系列答案
相关题目
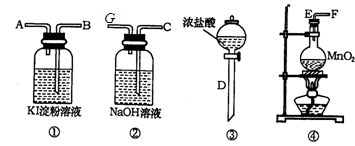
 的反应方程式:______ 。
的反应方程式:______ 。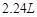 (标况下)为什么?___________________
(标况下)为什么?___________________  溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ . ol·L-1的NaOH溶液,配制时:
ol·L-1的NaOH溶液,配制时:
 烯中碳、氢两种元素的质量比。
烯中碳、氢两种元素的质量比。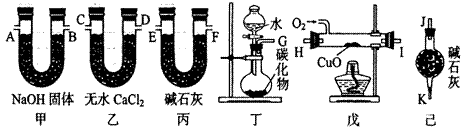
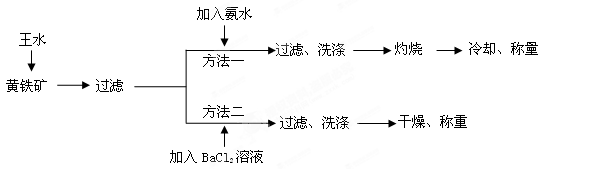
 S2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
S2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
 ,则该矿石中FeS2的质量分数是________________。
,则该矿石中FeS2的质量分数是________________。 的实验并回答相关问题。
的实验并回答相关问题。 除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。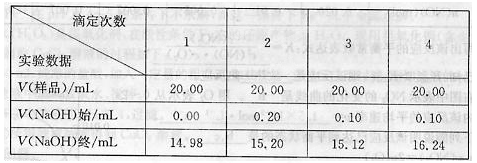
 “先产生沉淀,然后沉淀又溶解”现象的是( )
“先产生沉淀,然后沉淀又溶解”现象的是( )