题目内容
【题目】有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2 . 混合气体,所需试剂有:
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性高锰酸钾溶液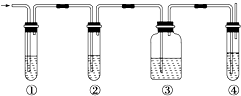
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内): ① , ② , ③ , ④ .
(2)使用装置②的目的是 .
(3)写出SO2与酸性高锰酸钾反应的离子方程式: .
【答案】
(1)A;B;A;D
(2)除去混合气体中的SO2
(3)5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+
【解析】解:本实验的目的是确认某混合气体中含有C2H4和SO2 , 乙烯与二氧化硫都具有还原性,都能够使酸性的高锰酸钾褪色,所以要检验乙烯、二氧化硫的存在,应先利用二氧化硫能够使品红褪色的性质检验二氧化硫的存在,然后利用氢氧化钠除去二氧化硫,再通过品红溶液检验二氧化硫是否除尽,最后通过酸性的高锰酸钾检验乙烯的存在,(1)图中①应盛放品红溶液,用来检验二氧化硫的存在;②中盛放氢氧化钠溶液,用来除去二氧化硫;③中盛放品红溶液,用来检验二氧化硫是否除尽;④装置可盛放的试剂是酸性的高锰酸钾,用来检验乙烯的存在;所以答案是:A,B,A,D;(2)二氧化硫的存在会对乙烯的检验造成干扰,二氧化硫为酸性氧化物,能够与氢氧化钠反应被氢氧化钠溶液稀释,所以②中盛放氢氧化钠溶液,用来除去二氧化硫;所以答案是;除去混合气体中的SO2;(3)二氧化硫具有还原性与酸性的高锰酸钾反应生成硫酸锰、硫酸,离子方程式:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;所以答案是:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ .

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
