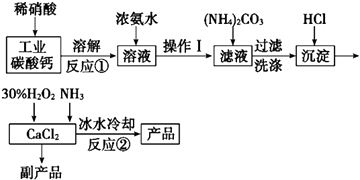
题目内容
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 .
(2)上述反应中的还原剂是 , 反应产生的气体可用吸收,吸收过程中发生的反应的离子方程式为 .
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2 , 写出该反应的化学方程式并用单线桥法表示电子转移的方向和数目:;
(4)若其氧化产物的总物质的量比还原产物的总物质的量少0.8mol,则反应中转移电子的物质的量为 .
【答案】
(1)1:1
(2)SnCl2;NaOH溶液;H2S+2OH﹣=2H2O+S2﹣、S2﹣+H2S=2HS﹣
(3)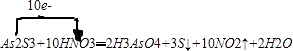
(4)1.6mol
【解析】解:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1,所以答案是:1:1;(2)反应中SnCl2中的Sn元素化合价升高,SnCl2为还原剂,H2S为酸性气体,可用NaOH溶液吸收,离子反应方程式为:H2S+2OH﹣=2H2O+S2﹣、S2﹣+H2S=2HS﹣ , 所以答案是:SnCl2;NaOH溶液;H2S+2OH﹣=2H2O+S2﹣、S2﹣+H2S=2HS﹣;(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2 , 所以反应的化学方程式为:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,用单线桥法表示电子转移的方向和数目为: 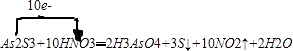 ,所以答案是:
,所以答案是: 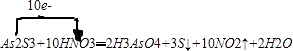 ;(4)设反应中转移电子的物质的量为x, 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,转移电子 氧化产物和还原产物的差
;(4)设反应中转移电子的物质的量为x, 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,转移电子 氧化产物和还原产物的差
2 1mol
x 0.8mol
x=2×0.8=1.6mol,所以答案是:1.6mol.