题目内容
19.由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应.若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是( )| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
分析 根据在高温下可能发生Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3FeO或4Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3Fe3O4时两种反应,或两种反应同时进行,根据加入铁的物质的量为1mol,结合化学方程式计算可能存在的物质的量的比值.
解答 解:分析题给混合物和高温下发生的反应,可知:
当发生反应:Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3FeO时,反应后混合物中含有6molFeO、4molFe2O3,则FeO与Fe2O3的物质的量之比为3:2;
当发生反应:4Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3Fe3O4时,反应后混合物中含有3molFeO、1molFe2O3,则FeO与Fe2O3的物质的量之比为3:1;
当两反应均存在时,FeO与Fe2O3的物质的量之比处于两者之间,
选项中可能为AD,
故选AD.
点评 本题考查了化学计算知识,题目难度中等,极端假设法是指根据已知的条件,把复杂问题假设为处于理想的极端状态,站在极端的角度去分析、考虑问题,使其因果关系显得十分明显、简单,从而迅速地作出正确判断的方法.比如此题中我们就假设了两个极端,首先确定两个极端,然后确定范围,最后选择.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
10.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2H++2CrO42- (黄色)
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
9.下列说法正确的是( )
| A. | 液氨是非电解质,但液态氯化氢是强电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,用蒸馏水分别稀释至原体积的m倍和n倍后两溶液的pH值仍相同,m和n的相对大小无法确定 | |
| C. | CuCl2+2H2O═Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | I-、K+、Na+、NO3-、Cl-一定可以在甲基橙呈黄色的溶液中大量共存 |

 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)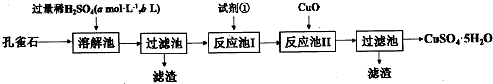
 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: