题目内容
(1)写出0.1mol/LNa2S溶液中的守恒关系,电荷守恒为
(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,(题中a<b,b≥8)问:
①若a+b=14,则
=
②若a+b=13,则
=
③若a+b>14,则
=
c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
,物料守恒为c(Na+)=2(HS-)+2c(H2S)+2c(S2-)
c(Na+)=2(HS-)+2c(H2S)+2c(S2-)
,溶液中各离子浓度的大小关系为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
.(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,(题中a<b,b≥8)问:
①若a+b=14,则
| Va |
| Vb |
1:1
1:1
;②若a+b=13,则
| Va |
| Vb |
1:10
1:10
;③若a+b>14,则
| Va |
| Vb |
10a+b-14
10a+b-14
且Va>
>
Vb(填“>”“<”“=”).分析:(1)由溶液不显电性,书写电荷守恒式;由原子守恒来书写物料守恒式,再结合水解来比较离子的浓度大小;
(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有VaL×10-amol/L=VbL×10b-14mol/L,即
=10a+b-14,以此来计算.
(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有VaL×10-amol/L=VbL×10b-14mol/L,即
| Va |
| Vb |
解答:解:(1)0.1mol/LNa2S溶液中溶液不显电性,则电荷守恒式为c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),由原子守恒可知物料守恒式为c(Na+)=2(HS-)+2c(H2S)+2c(S2-),因硫离子水解,则离子的浓度大小为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);c(Na+)=2(HS-)+2c(H2S)+2c(S2-);c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有VaL×10-amol/L=VbL×10b-14mol/L,即
=10a+b-14,
①若a+b=14,则
=10a+b-14=1:1,故答案为:1:1;
②若a+b=13,则
=10a+b-14=1:10,故答案为:1:10;
③若a+b>14,则
=10a+b-14>1,即Va>Vb,故答案为:10a+b-14;>.
故答案为:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);c(Na+)=2(HS-)+2c(H2S)+2c(S2-);c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有VaL×10-amol/L=VbL×10b-14mol/L,即
| Va |
| Vb |
①若a+b=14,则
| Va |
| Vb |
②若a+b=13,则
| Va |
| Vb |
③若a+b>14,则
| Va |
| Vb |
点评:本题考查盐类水解和酸碱中和的计算,明确溶液不显电性及原子守恒的关系、酸碱中和时氢离子与氢氧根离子的物质的相同是解答本题的关键,题目难度中等.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
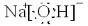
 =______;
=______; =______;
=______; =______且Va______Vb(填“>”“<”“=”).
=______且Va______Vb(填“>”“<”“=”).