题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.46 g NO2和N2O4的混合物中含有的氮原子数为NA |
| B.常温常压下,22.4L乙烯中含极性共价键数目为5NA |
| C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 NA |
| D.1 mol羟基(—OH)中含电子数为10 NA |
A
解析试题分析:A、NO2和N2O4的最简式为NO2,46g的二者的混合物中N、O原子的物质的量分别为1mol、2mol,所以混合物中含有的氮原子数为NA,正确;B、常温常压下的气体无法计算其物质的量,从而不能计算乙烯中含极性共价键数目,错误;C、Fe3+水解会使其数目小于0.2 NA,错误;D、1 mol羟基(—OH)中含电子数为9NA,错误,答案选A。
考点:考查阿伏伽德罗常数的理解应用

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知Ba(AlO2)2可溶于水,向含有1 mol Al2(SO4)3的溶液中加入含有b mol Ba(OH)2 (b≠6)的溶液,所得沉淀的物质的量不可能为
| A.5mol | B.3mol | C.b/2mol | D.5b/3mol |
已知NH3和HCl都能用来作喷泉实验。若在同温同压下用等体积烧瓶,一个收集满NH3,另一个收集满HCl气体,做喷泉实验,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑溶质的扩散及静止时液面高度的影响)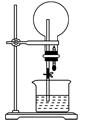
| A.溶质的物质的量浓度相同、溶质的质量分数不同 |
| B.溶质的质量分数相同,溶质的物质的量浓度不同 |
| C.溶质的物质的量浓度和溶质的质量分数都不同 |
| D.溶质的物质的量浓度和溶质的质量分数都相同 |
下列化学用语中表述正确的是( )
A.甲醛的电子式: |
| B.二氧化硅的分子式SiO2 |
C.丙烷的分子球棍模型示意图: |
D. 离子结构示意图: 离子结构示意图: |
a mol FeS与b mol FeO投入到V L、c mol·L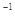 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
①(a+b)×63 g②(a+b)×189 g ③(a+b) mol④ mol
mol
| A.①④ | B.②③ | C.①③ | D.②④ |
下列化学用语表示正确的是 ( )。
A.Cl-的结构示意图: |
B.甲烷分子的球棍模型: |
C.氢氧化钠的电子式: |
| D.次氯酸的结构式:H—O—Cl |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )。
| A.10 g氖气中所含的原子数为NA |
| B.9 g重水含有的电子数为5 NA |
| C.标准状况下,将22.4 L氯化氢气体溶于足量水中,溶液中含有的氯化氢分子数为NA |
| D.常温常压下,22 g CO2中含有NA个C=O键 |
某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5 Fe1.5FeO4的流程图示意如下: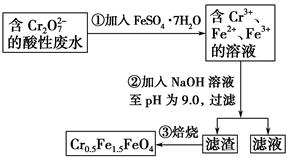
下列有关判断错误的是( )。
| A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3 |
| C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3 |
| D.若废水中杂质不与绿矾反应,将该1 L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g |
