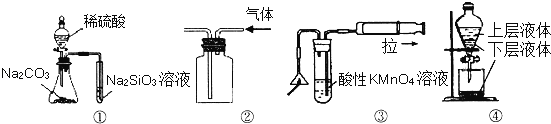
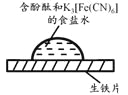
题目内容
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
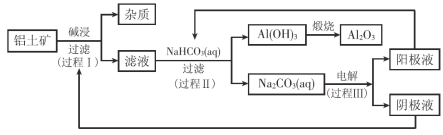
(1)过程I,发生反应的离子方程式是 。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
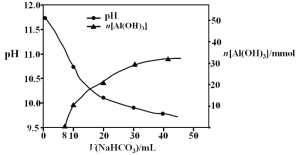
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是 。
② 过程II生成Al(OH)3的离子方程式是 。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
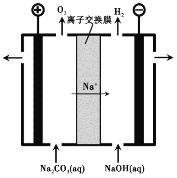
① 阴极的电极反应式是 。
② 简述阳极液生成的原理: 。
【答案】
(1)Al2O3+2OH-=2AlO2-+H2O
(2)①OH-+HCO3-=CO32-+H2O;②HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
(3)①2H2O+2e-=2OH-+H2↑;②2H2O-4e-=O2↑+4H+,溶液中c(H+)增大,发生反应:CO32-+H+=HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液
【解析】
试题分析:(1)过程I,铝土矿中氧化铝与碱反应生成偏铝酸钠根离子和水,反应的离子方程式为Al2O3 + 2OH-= 2AlO2-+ H2O,故答案为:Al2O3 + 2OH-= 2AlO2-+ H2O;
(2)① 加入NaHCO3溶液体积小于8 mL时,没有氢氧化铝沉淀生成,主要反应的离子方程式为OH- + HCO3-= CO32-+ H2O,故答案为:OH- + HCO3-= CO32-+ H2O;
② 过程II中碳酸氢根离子与偏铝酸钠根离子发生复分解反应,生成氢氧化铝沉淀和碳酸根,生成Al(OH)3的离子方程式为HCO3-+ AlO2-+ H2O = Al(OH)3↓+ CO32-,故答案为:HCO3-+ AlO2-+ H2O = Al(OH)3↓+ CO32-;
(3)①根据图像,阴极放出氢气,溶液中的水放电,电极反应式为2H2O + 2e-= 2OH-+ H2↑,故答案为:2H2O + 2e-= 2OH-+ H2↑;
②2H2O - 4e-= O2↑+ 4H+,溶液中c(H+)增大,发生反应:CO32-+ H+ = HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液,故答案为:2H2O - 4e-= O2↑+ 4H+,溶液中c(H+)增大,发生反应:CO32-+ H+ = HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 中心区:Fe–2e—==Fe2+
C. 边缘处:O2+2H2O+4e—==4OH—
D. 交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+