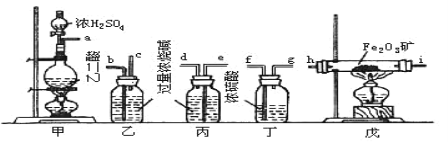
��Ŀ����
����Ŀ����ͼ�� Zn �� Cu �γɵ�ԭ��أ���ʵ��ȤС������ʵ����ڶ��鿨Ƭ�ϼ��½��ۡ�������ȷ��һ����( )
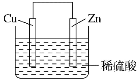
��Zn Ϊ������Cu Ϊ���� ��H+���ƶ� �۵������� Zn �����·���� Cu ��Cu ������ H2 ���� ������ 1 mol �����������ߣ�������� H2 Ϊ 0.5 mol �������ĵ缫��ӦʽΪ Zn��2e-=Zn2+
A.�٢ڢ�B.�ܢݢ�
C.�ۢܢ�D.�ڢۢ�
���𰸡�C
��������
Zn �� Cu �γɵ�ԭ����У�Zn��Cu���ã����Zn��������ʧȥ���ӣ�����������Ӧ��Cu���������������Һ�е�H+�õ����ӷ�����ԭ��Ӧ���ݴ˷����жϡ�
Zn �� Cu �γɵ�ԭ����У�Zn��Cu���ã����Zn��������ʧȥ���ӣ�����������Ӧ��Cu���������������Һ�е�H+�������ϵõ����ӷ�����ԭ��Ӧ��ԭ���װ���е�����Zn �����·���� Cu�������ĵ缫��ӦΪ2H++2e-=H2���������1 mol ������������ʱ�����ɵ�H2Ϊ0.5mol����ȷ��Ϊ�ۢܢݣ�
��ѡC��

��ϰ��ϵ�д�
�����Ŀ