题目内容
2.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应( )| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
分析 A.根据二烯烃与溴可发生1,2-加成或1,4-加成来判断;
B.2-氯丙烷(CH3CHClCH3)与NaOH乙醇溶液共热发生消去反应生成丙烯;
C.丙烷中含有2种位置的H原子;
D.苯环上的两种取代基有邻、间、对三种不同位置.
解答 解:A.异戊二烯与溴可发生1,2-加成或1,4-加成两种物质,则存在同分异构体,故A错误;
B.2-氯丙烷(CH3CHClCH3)与NaOH乙醇溶液共热发生消去反应生成丙烯,不存在同分异构体,故B正确;
C.丙烷中含有2种位置的H原子,则与氯气发生取代反应生成两种一氯代物,存在同分异构体,故C错误;
D.甲苯在一定条件下发生硝化生成一硝基甲苯的反应,可生成邻-硝基甲苯、间-硝基甲苯和对-硝基甲苯三种物质,则存在同分异构体,故D错误;
故选B.
点评 本题考查有机物的性质,依次来判断产物是否存在同分异构体,做此类题目要注意根据有机物的结构特点分析可能的产物,本题难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
12.从结构上分析推测,CH2=CHCOOCH2CH3,最不可能具有的性质是( )
| A. | 能使溴水褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能水解 | D. | 能够与Na2CO3溶液反应 |
10.随着碱金属元素原子序数的增大,下列递变规律正确的是( )
| A. | 原子半径逐渐增大 | B. | 碱性逐渐减弱 | ||
| C. | 单质熔、沸点逐渐升高 | D. | 单质的氧化性逐渐增强 |
17.可逆反应2NO2(红棕色)?2NO(无色)+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
14.下列有关水溶液中离子平衡关系的说法中,正确的是( )
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
4.核磁共振氢谱(1HNMR)是研究有机物分子结构的方法之一,每个有机物分子结构中的氢原子在1HNMR上都给出了相应的红外吸收峰(信号),每种峰的强度与结构中的氢原个子数成正比.则乙醇(CH3CH2OH)分了在1HNMR中的信号和强度分别是( )
| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
5.针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )

| A. | 在Ag催化下与O2反应时,①、③键断裂 | B. | 分子间脱水时,①②键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | D. | 与醋酸、浓硫酸共热时,②键断裂 |
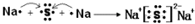 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.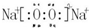 ;
;