题目内容
11.下列实验操作使测定(或配制)结果偏高的是( )| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
分析 A、定容时俯视刻度线,会导致溶液体积偏小;
B、称量固体时,应左物右码,则物品的质量等于砝码的质量加游码的质量;
C、中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释不影响待测液的物质的量;
D、中和热的测定必须做好保温隔热的工作.
解答 解:A、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故A正确;
B、称量固体时,砝码错放在左盘,会导致药品的质量偏小,则所配溶液的浓度偏低,故B错误;
C、中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释不影响待测液的物质的量,对标准液的消耗量无影响,故对测定结果无影响,故C错误;
D、在敞口容器中测量氢氧化钠和稀盐酸反应的中和热会导致热量的散失,则所测中和热的数值将偏小,故D错误.
故选A.
点评 本题考查了常见实验操作中的误差分析,应注意的是在待测液中加入水或锥形瓶不干燥对测定结果无影响.

练习册系列答案
相关题目
2.W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子.下列说法正确的( )
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族元素的原子次外层电子数可能为2或8,不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
19.已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是( )X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W.
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
20.下列各组有机物中互为同分异构体的是( )
| A. |  和 和 | B. | CH3CH2CH2OH和CH3CHOHCH3 | ||
| C. |  和 和 | D. |  和 和 |
1.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
| A. | 钠熔化成小球 | |
| B. | 钠块沉在乙醇液面的下面 | |
| C. | 钠块在乙醇的液面上游动 | |
| D. | 钠块表面有气泡放出,有轻微爆炸产生 |
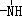 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.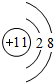 ,C的原子结构示意图是
,C的原子结构示意图是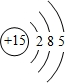 .
.