题目内容
373K时,H![]()
![]() +OH-═
+OH-═![]() +H
+H![]() O反应的实验结果为:
O反应的实验结果为:
|
项目 |
1 |
2 |
3 |
|
H |
0.10 |
0.50 |
0.50 |
|
OH-起始浓度/mol×dm-3 |
1.0 |
1.0 |
4.0 |
|
反应速率/mol×dm-3×s-1 |
3.2´10-5 |
1.6´10-4 |
2.56´10-3 |
请确定这个反应的速率表达式_____________________________________。
答案:
解析:
提示:
解析:
v=kc(H2PO2-)·[c(OH-)]2
|
提示:
提示:从表中可知,当OH-起始浓度均为1.0mol×dm-3时,
即v与c(H2PO2-)成正比。 又知当H2PO2-起始浓度均为0.50mol×dm-3时,
即v又与[c(OH-)]2成正比。 故反应速率与H2PO2-的浓度,OH-的浓度存在如下关系(k为常数): v=kc(H2PO2-)× [c(OH-)]2
|

练习册系列答案
相关题目
373K时,H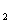
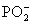 +OH-═
+OH-═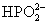 +H
+H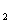 O反应的实验结果为:
O反应的实验结果为:
|
项目 |
1 |
2 |
3 |
|
H |
0.10 |
0.50 |
0.50 |
|
OH-起始浓度/mol×dm-3 |
1.0 |
1.0 |
4.0 |
|
反应速率/mol×dm-3×s-1 |
3.2´10-5 |
1.6´10-4 |
2.56´10-3 |
请确定这个反应的速率表达式_____________________________________。

