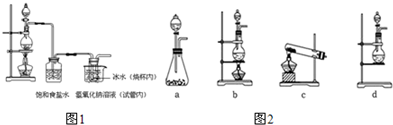
题目内容
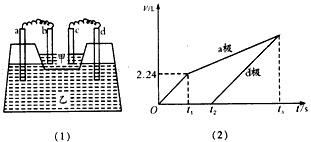
如图(1)所示装置,甲槽中盛放AgNO3溶液,乙槽中盛放AlCl3和M(NO3)x(x≥1,x为正整数)的混合溶液,其中甲槽中一个电极为锌电极,其余均为石墨电极,且接通线路前各电极质量相等。接通线路一段时间,测得乙槽中a、d两极所得气体的体积(标准状况下)随时间变化的关系如图(2)所示。
请回答下列问题:
(1)d极为________极,c极的电极反应方程式为____________________
(2)t2时刻,测得b、c两电极的质量相差32.8 g,b、d两电极质量相差22.8 g,则:
①M(NO3)x的化学式为_________。
②t1~t2时,乙槽中的反应方程式为__________________。
③t2~t3时,乙槽中溶液pH____(填“增大”“减 小”或“不变”)。
④如果在t3时刻,反应刚好停止(电极都没用完),则 n(AgNO3):n[M(NO3)x]=____________。
(1)d极为________极,c极的电极反应方程式为____________________
(2)t2时刻,测得b、c两电极的质量相差32.8 g,b、d两电极质量相差22.8 g,则:
①M(NO3)x的化学式为_________。
②t1~t2时,乙槽中的反应方程式为__________________。
③t2~t3时,乙槽中溶液pH____(填“增大”“减 小”或“不变”)。
④如果在t3时刻,反应刚好停止(电极都没用完),则 n(AgNO3):n[M(NO3)x]=____________。
(1)负;Zn-2e-=Zn2+
(2)①Cu(NO3)2;②2Cu(NO3)3+2H2O 2Cu+4HNO3+O2↑;③减小;④16:3
2Cu+4HNO3+O2↑;③减小;④16:3
(2)①Cu(NO3)2;②2Cu(NO3)3+2H2O
 2Cu+4HNO3+O2↑;③减小;④16:3
2Cu+4HNO3+O2↑;③减小;④16:3 
练习册系列答案
相关题目
某同学设计如图1所示装置分别进行以下探究实验(夹持装置已略去,忽略滴入液体体积对气体体积的影响)
:
请回答下列问题:
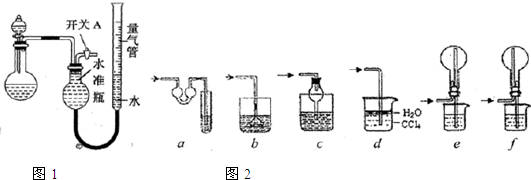
(1)实验过程中,使用分液漏斗滴加液体的操作是 .
(2)该同学认为实验I不可通过收集并测量NO气体的体积来探究铜样品的纯度,请你分析其中原因是 .
(3)实验Ⅲ烧瓶中发生反应的化学方程式是 .打开开关A,产生的气体经验纯后点燃,现象是 .
(4)实验II中量气管中的液体最好是 .(选填序号)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理,以下各种尾气吸收装置中图2,适合于吸收NH3,而且能防止倒吸的有 .(选填序号)
(5)本实验应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,② ,③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均己换算成标准状况):
根据上述数据,可计算出镁铝合金中铝的质量分数为 .
:
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀硝酸 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 电石、饱和食盐水 | C2H2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |

(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)该同学认为实验I不可通过收集并测量NO气体的体积来探究铜样品的纯度,请你分析其中原因是
(3)实验Ⅲ烧瓶中发生反应的化学方程式是
(4)实验II中量气管中的液体最好是
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理,以下各种尾气吸收装置中图2,适合于吸收NH3,而且能防止倒吸的有
(5)本实验应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,②
(6)实验Ⅳ获得以下数据(所有气体体积均己换算成标准状况):
| 编号 | 镁铝合金质量 | 量气管第1次读数 | 量气管第2次读数 |
| ① | 1.0g | 10.0mL | 347.5mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 344.5mL |
如图1所示是实验室中制取气体的一种简易装置.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为 .
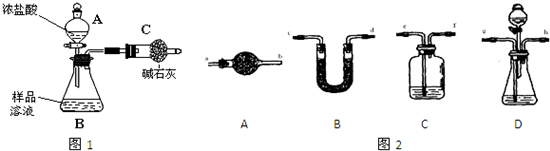
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为 (计算结果保留两位小数).若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、 .
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |

 .
.