题目内容
4.室温时,下列液体的密度比纯水密度大的是( )| A. | 1-氯丁烷 | B. | 汽油 | C. | 溴乙烷 | D. | 乙醇 |
分析 有机物,支链越多,密度越小、所有烃的密度均小于1;碘代烃、四氯化碳、氯仿、溴苯、二硫化碳、溴乙烷后的溴代烷、硝基苯的密度大于1,据此解答.
解答 解:A.1-氯丁烷密度小于水的密度,故A不选;
B.汽油密度小于水,故B不选;
C.溴乙烷密度大于水,故C选;
D.乙醇密度小于水,故D不选;
故选:C.
点评 本题主要考查了物质的物理性质,熟悉常见有机物密度大小是解题关键,题目难度不大,注意对相关性质的积累.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
14.在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断错误的是( )


| A. | NaOH的浓度为0.6 mol•L-1 | B. | 在a点处溶液中的溶质为NaCl | ||
| C. | 混合溶液中n(Al3+):n(Mg2+)=2:1 | D. | 图中线段oa:ab=5:1 |
15.某同学为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能检验出一定存在的离子是( )
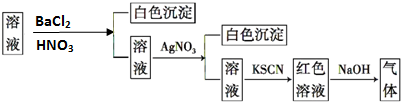

| A. | SO42-、NH4+ | B. | Cl- | C. | Fe3+ | D. | NH4+ |
12.下列关于SO2性质的说法中,正确的是( )
| A. | 能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| B. | 能使澄清石灰水变浑浊 | |
| C. | 不能与NaOH溶液反应 | |
| D. | 能与水反应生成硫酸 |
19.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | Y的最高正价为+6 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
9.把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)?xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L•min),下列叙述错误的是( )
| A. | 5min内P的平均反应速率为0.15mol/(L•min) | |
| B. | Q的平衡浓度为1mol/L | |
| C. | Q的转化率为25% | |
| D. | x是2 |
16.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH.则下列说法正确的是( )
| A. | 电解过程中阴极没有气体生成 | |
| B. | 电解过程中转移的电子的物质的量为0.4 mol | |
| C. | 原CuSO4溶液的浓度为0.1 mol•L-1 | |
| D. | 电解过程中阳极收集到的气体体积为2.24 L(标况下) |
13.物质的分离、提纯是中学化学的重要操作,请应用物质分离、提纯知识,分离下列各组混合物.
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
11.“化学是你,化学是我”,说明了化学知识在生活中的普遍性.下列说法正确的是( )
| A. | 纤维素水解的产物可以制乙醇 | |
| B. | 乙烯、聚乙烯、聚氯乙烯都属于烃,都可以使溴水褪色 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | NH4NO3、KNO3、KClO3与Na2S、C2H5OH混合搭存放在同一仓库 |