题目内容
 (1)将反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计成原电池其装置如图.电极X的材料是
(1)将反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计成原电池其装置如图.电极X的材料是Cu
Cu
;乙池中电极反应为2Ag++2e-=2Ag
2Ag++2e-=2Ag
;外电路中的电子流向Ag
Ag
电极.(2)取出盐桥后,电流计的指针
不能
不能
(填“能”或“不能”)发生偏转.(3)若甲、乙溶液反应前均为100mL,1mol/L.当外电路中转移0.02mol电子时,理论上X极的质量将减少
0.64
0.64
g,将乙溶液全部蒸干灼烧,最后可得固体的质量为8.84
8.84
g.分析:(1)在原电池中,根据2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)知,铜作负极,发生氧化反应,银作正极,发生还原反应,甲池中的电解质溶液为硫酸铜,乙池中的电解质溶液为可溶性的银盐;
(2)取出盐桥后,不能形成原电池反应,电流计不能发生偏转;
(3)根据电极反应时计算两极以及溶液溶质的物质的量的变化,可计算该题.
(2)取出盐桥后,不能形成原电池反应,电流计不能发生偏转;
(3)根据电极反应时计算两极以及溶液溶质的物质的量的变化,可计算该题.
解答:解:(1)由2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)知,铜作负极,即X,发生氧化反应,银作正极,发生还原反应,正极反应为2Ag++2e-=2Ag,原电池工作时,电子由负极应外电路流向正极,即流向银极,
故答案为:Cu;2Ag++2e-=2Ag;Ag;
(2)取出盐桥后,不能形成原电池反应,电流计不能发生偏转,故答案为:不能;
(3)若甲、乙溶液反应前均为100mL,1mol/L.当外电路中转移0.02mol电子时,因负极反应为Cu-2e-=Cu2+,理论上X极的质量将减少0.01mol×64g/mol=0.64g,
乙中发生2Ag++2e-=2Ag,消耗0.02molAg+,反应后溶液剩余Ag+为0.1mol-0.02mol=0.08mol,将乙溶液全部蒸干灼烧,硝酸银分解生成Ag,最后可得固体质量为0.08mol×108g/mol=8.84g,
故答案为:0.64;8.84.
故答案为:Cu;2Ag++2e-=2Ag;Ag;
(2)取出盐桥后,不能形成原电池反应,电流计不能发生偏转,故答案为:不能;
(3)若甲、乙溶液反应前均为100mL,1mol/L.当外电路中转移0.02mol电子时,因负极反应为Cu-2e-=Cu2+,理论上X极的质量将减少0.01mol×64g/mol=0.64g,
乙中发生2Ag++2e-=2Ag,消耗0.02molAg+,反应后溶液剩余Ag+为0.1mol-0.02mol=0.08mol,将乙溶液全部蒸干灼烧,硝酸银分解生成Ag,最后可得固体质量为0.08mol×108g/mol=8.84g,
故答案为:0.64;8.84.
点评:本题综合考查原电池知识,为高考常见题型,综合考查原电池的原理、电极方程式的书写以及相关计算,综合考查学生的分析能力和计算能力,难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
 过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
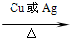 2CH3CHO+2H2O
2CH3CHO+2H2O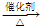
 ,
, CH3COOC2H5+H2O,
CH3COOC2H5+H2O, 理论上讲,任何自发的氧化还原反应都可以设计成原电池.
理论上讲,任何自发的氧化还原反应都可以设计成原电池.