题目内容
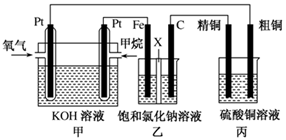
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
(14分)(每空2分)
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s) Ba2+(aq)+ +CO32- (aq)
Ba2+(aq)+ +CO32- (aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)2Cl?+2H2O H2↑+Cl2↑+2OH?
H2↑+Cl2↑+2OH?
解析

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: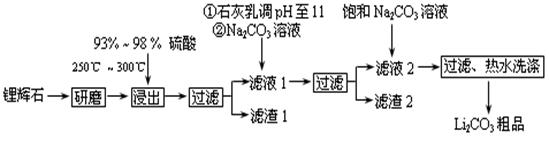
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式: 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。
下列物质一定属于同系物的是( )
| A.⑤⑦ | B.④⑥ | C.⑥⑧ | D.①③ |
化合物M叫假蜜环菌甲素(如右图), 它是香豆素类天然化合物。对M性质叙述正确的是
它是香豆素类天然化合物。对M性质叙述正确的是
| A.M能与FeCl3发生反应,不能与CH3COOH发生反应 |
| B.M与Br2只能发生取代反应,不能发生加成反应 |
| C.1molM最多可消阿耗3mol NaOH |
| D.1molM在催化剂作用下最多能与4molH2发生加成反应 |