题目内容
5.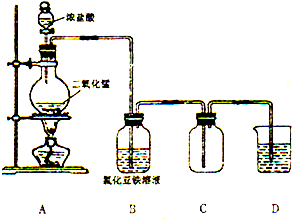 某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】
某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】【实验探究】
(1)按上图连接好装置后,实验开始前要(填“要”或“不要”)对装置进行气密性检查.
(2)装置B中氯气与FeCl2溶液反应生成FeCl3的化学方程式为2FeCl2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(3)氯气可用装置C来收集,说明Cl2的密度比空气大(填“大”或“小”).
(4)为了收集干燥的Cl2,可在装置B、C之间连接盛有浓硫酸(填“浓硫酸”或“Na2CO3溶液”)的洗气瓶.
(5)为了吸收残余的氯气,防止空气污染,装置D中应盛放NaOH溶液(填“NaOH溶液”或“饱和NaCl溶液”).
(6)若生成标准状况下2.24LCl2,则参加反应的MnO2物质的量为0.1mol.
【知识拓展】
(7)漂白粉(主要成分是氯化钙和次氯酸钙)是利用氯气与氢氧化钙反应制成的,填写下列化学反应方程式:2Ca(OH)2+2Cl2═CaCl2++2H2O该反应是(填“是”或“不是”)氧化还原反应.
【知识应用】
(8)目前,我国不少自来水厂用氯气杀菌、消毒,其原理为:Cl2+H2O=HCl+HClO,次氯酸具有强的氧化性,具有杀菌消毒作用.
分析 (1)制备气体,连接装置后,应进行装置气密性检查;
(2)氯气与氯化亚铁反应生成氯化铁;
(3)C装置收集气体,长进短出,说明气体密度应大于空气密度;
(4)浓硫酸具有吸水性,可以干燥氯气;
(5)氯气能够与碱性物质反应,通常用碱性物质吸收过量的氯气;
(6)计算标准状况下2.24LCl2物质的量,依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O计算需要二氧化锰的物质的量;
(7)氧化还原反应判断依据:有化合价的变化的反应;
(8)氯气与水反应生成的次氯酸具有杀菌消毒作用.
解答 解:(1)制备气体,连接装置后,应进行装置气密性检查;
故答案为:要;
(2)氯气与氯化亚铁反应生成氯化铁,化学方程式:2FeCl2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2FeCl2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)C装置收集气体,长进短出,说明气体密度应大于空气密度;
故答案为:大;
(4)为了收集干燥的Cl2,可在装置B、C之间连接盛有浓硫酸的洗气瓶;
故答案为:浓硫酸;
(5)氯气能够与氢氧化钠溶液反应,可用氢氧化钠吸收过量的氯气,进行尾气处理;
故答案为:氢氧化钠溶液;
(6)标准状况下2.24LCl2物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知生成1mol氯气消耗二氧化锰物质的量为1mol,则生成0.1mol氯气,消耗二氧化锰的物质的量为0.1mol;
故答案为:0.1;
(7)2Ca(OH)2+2Cl2═CaCl2+2H2O,反应中氯元素化合价存在变化,属于氧化还原反应;
故答案为:是;
(8)我国不少自来水厂用氯气杀菌、消毒,其原理为氯气与水生成氯化氢和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有强的氧化性,具有杀菌消毒作用;
故答案为:Cl2+H2O=HCl+HClO,次氯酸具有强的氧化性,具有杀菌消毒作用.
点评 本题考查了氯气的制备和性质检验,明确实验室制备氯气的原理及氯气、次氯酸的性质是解题关键,注意氧化还原反应判断依据,题目难度不大.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 已知2H 2(g)+O 2(g)═2H 2O(g);△H=-483.6KJ•mol -1,则氢气的燃烧热为241.8kJ•mol -1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2O(1);△H=-57.4kJ•mol -1则含 20.0gNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| D. | 己知2C(s)+2O 2(g)═2CO 2(g);△H=akJ•mol -1、2C(s)+O 2(g)═2CO(g);△H=bkJ•mol -1,则a>b |
| A. | 168O和188O | B. | CH3CH3和C6H6 | C. | 金刚石和石墨 | D. | NO和 NO2 |
| A. | 氢气 | B. | 二氧化碳 | C. | 氧气 | D. | 氮气 |
| 化学键 | H-H | N≡N | H-N |
| 键能 | 436 kJ/mol | x | 391kJ/mol |
| A. | 431kJ/mol | B. | 946kJ/mol | C. | 649kJ/mol | D. | 869kJ/mol |
 过氧化氢的电子式
过氧化氢的电子式
 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4. .
.