题目内容
【题目】将锌铜合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
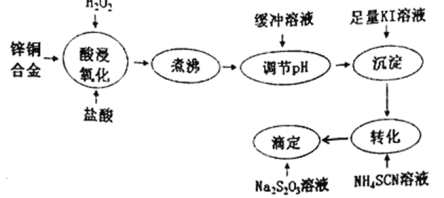
回答下列问题:
(1)H2O2的电子式为___________;“酸浸氧化”后铜元素的主要存在形式是___________(填离子符号)。
(2)“煮沸”的目的是____________________________________________。
(3)用缓冲溶液“调pH”是为了避免溶液的酸性太强,否则“滴定”时发生反应的离子方程式:_______________________________________________________;
①若100mLNa2S2O3溶液发生上述反应时,20s后生成的SO2比S多6.4g,则v(Na2S2O3)=___________mol/(L·s)(忽略溶液体积变化的影响)。
②该缓冲溶液是浓度均为0.10mol/L的CH3COOH和 CH3 COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________________________________。(已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5)
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为______________________。
(5)“转化”步骤中,CuI转化为 CuSCN, CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥___________。(已知:Ksp(CuI)=1.0×10-12;Ksp( CuSCN)=4.4×10-15)
(6)下列情况可能造成测得的铜含量偏高的是___________(填标号)。
A.铜锌合金中含少量铁
B.“沉淀”时,I2与I-结合生成I3-:I2+ I-= I3-
C.“转化后的溶液在空气中放置太久,没有及时滴定
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水
【答案】![]() Cu2+ 除去过量的H2O2 S2O32-+2H+=S↓+SO2↑+H2O 0.1 c(CH3COO-)>c(NH4+)>c(H+)>c(OH-) 2Cu2++4I-=2CuI+I2 4.4×10-3 AC
Cu2+ 除去过量的H2O2 S2O32-+2H+=S↓+SO2↑+H2O 0.1 c(CH3COO-)>c(NH4+)>c(H+)>c(OH-) 2Cu2++4I-=2CuI+I2 4.4×10-3 AC
【解析】
(1)H2O2是共价化合物,其电子式为![]() ;铜在酸性条件下被氧化为Cu2+;
;铜在酸性条件下被氧化为Cu2+;
(2)H2O2不稳定,加热后能除去;
(3)酸性太强,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O;
①由反应S2O32-+2H+=S↓+SO2↑+H2O可知,每生成1molSO2和1molS,生成的SO2比S多32g,据此计算参加反应的硫代硫酸钠的物质的量,再根据![]() =
=![]() 计算速率;
计算速率;
②根据25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5可知,CH3COONH4溶液呈中性,故等浓度的CH3COOH和 CH3COONH4的混合溶液呈酸性,据此分析离子浓度大小;
(4)Cu2+与I-生成CuI,据此写出反应的离子方程式;
(5)根据c(SCN-):c(I-)≥![]() 计算。
计算。
(6)根据反应式2Cu2++4I-=2CuI+I2,凡能造成I2偏大的,所测铜含量偏高分析。
(1)H2O2是共价化合物,其电子式为![]() ;铜在酸性条件下被H2O2氧化为Cu2+,所以溶解后铜元素以Cu2+形式存在;
;铜在酸性条件下被H2O2氧化为Cu2+,所以溶解后铜元素以Cu2+形式存在;
因此,本题正确答案为:![]() ;Cu2+;
;Cu2+;
(2)H2O2不稳定,加热后能除去,所以“煮沸”的目的是除去过量的H2O2;
因此,本题正确答案为:除去过量的H2O2;
(3)酸性太强,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O;
①由反应S2O32-+2H+=S↓+SO2↑+H2O可知,每生成1molSO2和1molS,生成的SO2比S多32g,20s后生成的SO2比S多6.4g,则20s后生成0.2molSO2,参加反应的硫代硫酸钠为0.2mol,故![]() (Na2S2O3)=
(Na2S2O3)=![]() =0.1mol/(L·s);
=0.1mol/(L·s);
②根据25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5可知,CH3COONH4溶液呈中性,故等浓度的CH3COOH CH3COONH4的混合溶液呈酸性,则溶液中各种离子浓度由大到小的顺序为c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)。
因此,本题正确答案为:S2O32-+2H+=S↓+SO2↑+H2O;0.1;c(CH3COO-)>c(NH4+)>c(H+)>c(OH-);
(4)Cu2+与I-生成CuI,反应的离子方程式为2Cu2++4I-=2CuI+I2;
因此,本题正确答案为:2Cu2++4I-=2CuI+I2;
(5)Ksp(CuI)=c(Cu2+)![]() c(I-)=1.0×10-12;Ksp( CuSCN)= c(Cu2+)
c(I-)=1.0×10-12;Ksp( CuSCN)= c(Cu2+)![]() c(SCN-)=4.4×10-15,则沉淀完全转化后,溶液中c(SCN-):c(I-)≥
c(SCN-)=4.4×10-15,则沉淀完全转化后,溶液中c(SCN-):c(I-)≥![]() =
=![]() =4.4×10-3,
=4.4×10-3,
因此,本题正确答案为:4.4×10-3。
(6)A.Fe3+也能与I-反应生成I2,铜锌合金中含少量铁,则会造成测得的铜含量偏高,A项符合题意;
B.“沉淀”时生成I3-,会造成测得的铜含量偏低,B项不符合题意;
C.空气中的氧气能氧化碘离子生成碘单质,若转化后的溶液在空气中放置太久,则会造成测得的铜含量偏高,C项符合题意;
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水,对实验结果无影响,D项不符合题意。
因此,本题正确答案为:AC。

【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L