题目内容
【题目】今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液。欲将Ba2+、Ag+、Fe3+分离,分别得到三种元素的不溶物,按下图所示实验:
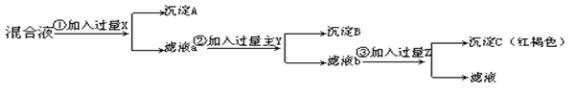
⑴加入的试剂分别是:X________,Y_________,Z_________。
⑵生成的沉淀A是__________,B是___________,C是___________。
⑶第②步和第③步的离子方程式分别是________________________________________________。
【答案】盐酸 硫酸 氢氧化钠溶液 AgCl BaSO4 Fe(OH)3 Ba2++SO42-==BaSO4↓ H++OH-=H2O Fe3++3OH-=Fe(OH)3↓
【解析】
依据物质溶解度和流程可知,先加入盐酸沉淀银离子,过滤后加入稀硫酸沉淀钡离子,最后加入强碱沉淀铁离子,据此解答。
(1)沉淀钡离子一般用硫酸根离子,沉淀银离子一般用氯离子,沉淀铁离子一般用氢氧根离子,由于硫酸银微溶于水,所以首先沉淀银离子,即X是HCl,根据流程图可知最后得到红褐色沉淀,则Y是H2SO4,用来沉淀钡离子,Z是NaOH,用来沉淀铁离子,即加入的试剂X、Y、Z分别是盐酸、硫酸、氢氧化钠溶液。
(2)根据以上分析可知生成的沉淀A、B、C分别是是AgCl、BaSO4、Fe(OH)3。
(3)根据以上分析可知反应第②步的离子方程式是Ba2++SO42-=BaSO4↓。由于前面加入的硫酸是过量的,则第③步的离子方程式为H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓。

练习册系列答案
相关题目