题目内容
6.常温时的下列溶液,说法正确的是( )| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | CH3COONa溶液与HCl溶液混合所得的中性溶液中:c(Na+)>c(Cl-) | |
| C. | Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | pH=8的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(OH-) |
分析 A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
B.溶液为中性,则c(H+)=c(OH-),结合电荷守恒判断;
C.根据混合液中的电荷守恒分析;
D.碳酸氢钠溶液的pH=8,说明碳酸氢根离子的水解程度大于其电离程度,则c(OH-)>c(CO32-).
解答 解:A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=14-a,如为碱溶液,则pH=a,故A错误;
B.CH3COONa溶液与HCI溶液混合所得的中性溶液中:c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)+c(Cl-),所以c(Na+)>c(Cl-),故B正确;
C.Na2S和NaHS的混合溶液中,根据电荷守恒可得:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C错误;
D.pH=8的NaHCO3溶液显示碱性,HCO3-的水解程度大于电离程度,则正确的离子浓度大小为:c(HCO3-)>c(OH-)>c(CO32-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及电荷守恒、物料守恒的含义为解答关键,注意掌握判断离子浓度大小常用方法,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
16.关于硝酸的性质,叙述错误的是( )
| A. | 无色、易挥发,有刺激性气味的液体 | |
| B. | 浓度为98%以上的浓硝酸叫发烟硝酸,具有脱水性 | |
| C. | 浓硝酸通常显黄色,因为溶解了少量的二氧化氮 | |
| D. | 硝酸不稳定,浓度越大越易分解 |
14.将甲、乙两种气体同时通入过量的丙溶液中,可能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | CO2 | SO3 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | O2 | NH3 | MgCl2 |
| A. | ①②⑤ | B. | ①③⑤⑥ | C. | ①②④⑤ | D. | 全部 |
18.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
(1)砷原子核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
15.已知CH3CH2Br+2Na+CH3CH2Br→CH3CH2CH2CH3+2NaBr.下列有机物发生这种反应可生成X,若X与环丙烷互为同系物,则能生成X的是( )
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH(CH3)CH2Br | ||
| C. | CH3CHBrCH2CH2Br | D. | CH3CH2Br |
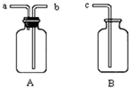 如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.
如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.