题目内容
【题目】类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ | 类比推理陈述Ⅱ | |
A | 单质的熔点Br2 < I2 | 单质的熔点Li < Na |
B | 工业上电解熔融的Al2O3得到铝单质 | 工业上电解熔融的MgO得到镁单质 |
C | 还原性:I- > Br- | 还原性:P3- > N3- |
D | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
A.AB.BC.CD.D
【答案】C
【解析】
A. 分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比,卤族元素单质都是分子晶体且其相对分子质量:![]() ,所以单质熔点:
,所以单质熔点:![]() ,而金属晶体熔沸点与其金属键强弱有关,金属键强弱与离子所带电荷成正比、与离子半径成反比,金属键:
,而金属晶体熔沸点与其金属键强弱有关,金属键强弱与离子所带电荷成正比、与离子半径成反比,金属键:![]() ,则单质熔点:
,则单质熔点:![]() ,故A错误;
,故A错误;
B.![]() 的熔点远远高于
的熔点远远高于![]() ,且熔融
,且熔融![]() 导电,从减少资源浪费方面考虑,工业上采用电解熔融
导电,从减少资源浪费方面考虑,工业上采用电解熔融![]() 方法冶炼
方法冶炼![]() ,故B错误;
,故B错误;
C. 元素的非金属性越强,其简单阴离子的还原性越弱,非金属性![]() ,所以还原性
,所以还原性![]() ,故C正确;
,故C正确;
D.碳酸氢钠的溶解度小于碳酸钠,故D错误;
答案选C。

【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
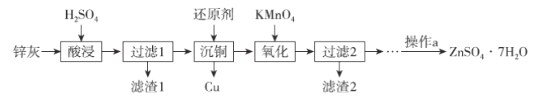
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。