题目内容
【题目】铬铁矿的要紧成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
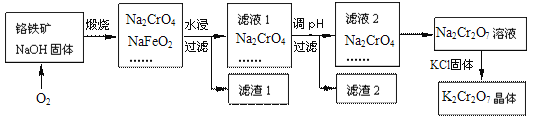
已知:①NaFeO2遇水强烈水解。
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
请回答:
(1)K2Cr2O7中Cr元素的化合价是___。
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是___。
(3)滤渣1为红褐色的固体,滤渣1的成分是(填名称)____,滤液1的成分除Na2CrO4、NaOH外,还含有___(填化学式)。
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是___。
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是___。
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、____、过滤、洗涤、干燥。
【答案】+6 4FeO·Cr2O3+20NaOH+ 7O2= 8Na2CrO4+ 4NaFeO2+10H2O 氢氧化铁 NaAlO2、Na2SiO3 2 Al2O3(熔融)![]() 4Al+3O2↑ 加硫酸酸化 冷却结晶
4Al+3O2↑ 加硫酸酸化 冷却结晶
【解析】
(1)根据化合物中各元素的化合价代数和为0的原则判断K2Cr2O7中Cr元素的化合价;
(2)由流程图判断,滤液1的成分除Na2CrO4、NaOH外,还有氧化铝、二氧化硅与氢氧化钠反应生成的NaAlO2,Na2SiO3;
(3)根据滤渣1是红褐色推断有氢氧化铁,是NaFeO2水解的产物;
(4)根据题目信息:2CrO42-+2H+=Cr2O72-+H2O,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;
(5)从溶液中获得晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
(1)根据化合物中各元素化合价代数和为零进行计算,K2Cr2O7中Cr元素的化合价是+6价;答案:+6;
(2)铬铁矿主要成分FeO·Cr2O3,加入氢氧化钠后通入氧气发生反应生成Na2CrO4和NaFeO2、水,其反应的化学方程式4FeO·Cr2O3+20NaOH+ 7O2= 8Na2CrO4+ 4NaFeO2+10H2O,答案:4FeO·Cr2O3+20NaOH+ 7O2= 8Na2CrO4+4 NaFeO2+10H2O。
(3)由题意NaFeO2遇水强烈水解,反应为滤渣1为红褐色的固体,即NaFeO2和水反应会产生红褐色沉淀,即NaFeO2+2H2O=NaOH+Fe(OH)3↓,生成的氢氧化钠和氧化铝反应生成偏铝酸钠,和二氧化硅反应生成硅酸钠,所以滤液1的成分除Na2CrO4外,还含有偏铝酸钠和硅酸钠,故答案为:氢氧化铁;NaAlO2、Na2SiO3;
(4)滤渣2可制得两种氧化物为氧化铝和二氧化硅,其中氧化铝可以经过电解冶炼可获得金属铝,该电解反应的化学方程式是:2 Al2O3(熔融)![]() 4Al+3O2↑,故答案为:2 Al2O3(熔融)
4Al+3O2↑,故答案为:2 Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(5)根据题目信息:2CrO42-+2H+=Cr2O72-+H2O,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;
(6)向K2Cr2O7溶液中加入KCl固体,加热时,重铬酸钠的溶解度随温度的升高而增大,但是氯化钾的受温度影响不大,所以获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶。

 阅读快车系列答案
阅读快车系列答案【题目】炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
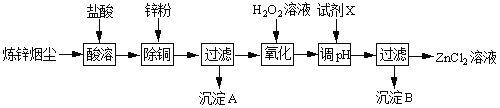
下表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1.1 | 5.2 | 5.8 |
沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(1)加入H2O2溶液的作用是___。
(2)流程图中,调节pH时,加入的试剂X可以是______(填序号),pH应调整到___。
A.ZnO B.NaOH C.Zn2(OH)2CO3 D.ZnSO4