题目内容
| |||||||||||
解析:
(1) |
(1)稀H2SO4、铁屑;(2)煮沸;(3)避免生成的Fe(OH)2沉淀接触O2 解析:根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4和铁屑;蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,因此可采用煮沸法除去O2.为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的. |
(2) |
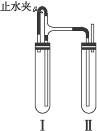
(1)稀H2SO4、铁屑;(2)NaOH溶液;(3)检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹;(4)试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入 解析:原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气.确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NAOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持. |
提示:
|
这是一道与Fe(OH)2的制备原理有关的题目,采用了创新的实验手法.对此类题目的完美解答,有赖于对基础知识的扎实掌握,对有关实验原理和仪器的熟知程度,并需要大胆的开拓和创新精神. |


 33、用下面两种方法可以制得白色的Fe(OH)2沉淀.
33、用下面两种方法可以制得白色的Fe(OH)2沉淀.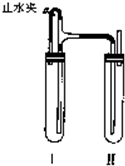 (2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
(2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.