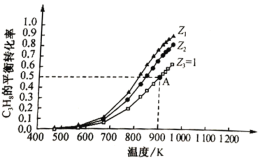
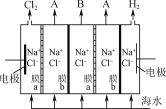
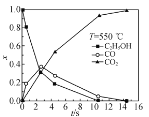
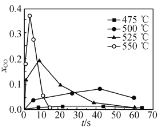
题目内容
【题目】判断下列离子方程式是否正确,错误的指明原因,并写出正确的离子方程式。____。
(1)铁粉溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑
(2)用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
(3)氢氧化铜溶于盐酸:OH-+H+=H2O
(4)氢氧化钡溶液与硫酸铜溶液混合:2OH-+Cu2+=Cu(OH)2↓
(5)铝与氯化铜溶液发生置换反应:Al+Cu2+=Al3++Cu
(6)硫酸溶液与氢氧化钡溶液混合:H++OH-+SO42-+Ba2+=BaSO4↓+H2O
(7)碳酸钙溶于硝酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合HCO3-+OH-=CO32-+H2O
【答案】
序号 | 正误 | 错误原因 | 正确的离子方程式 |
1 | × | 不符合反应的客观事实 | Fe+2H+═Fe2++H2↑ |
2 | × | 生成Fe(OH)3胶体,不是沉淀 | Fe3++3H2O |
3 | × | Cu(OH)2难溶,写化学式 | Cu(OH)2+2H+=2H2O+Cu2+ |
4 | × | 生成BaSO4和Cu(OH)2两种沉淀 | 2OH-+Cu2++SO42-+Ba2+=BaSO4↓+Cu(OH)2↓ |
5 | × | 原方程式两边电荷不守恒 | 2Al+3Cu2+=2Al3++3Cu |
6 | × | 生成BaSO4和H2O比例应为1:2 | 2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O |
7 | √ | ||
8 | × | Ca2+参加反应生成CaCO3沉淀 | Ca2+ + 2HCO3- +2OH- =CaCO3↓+ 2H2O+CO32- |
【解析】
(1)铁粉溶于稀硫酸中生成硫酸亚铁和氢气,离子方程式为:Fe+2H+═Fe2++H2↑,故(1)错误;原因:不符合反应的客观事实;
故答案为:错误;不符合反应的客观事实;Fe+2H+═Fe2++H2↑;
(2)用三氯化铁溶液制取Fe(OH)3胶体,生成Fe(OH)3胶体,不是沉淀:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;故(2)错误;原因:生成Fe(OH)3胶体,不是沉淀,故答案为:错误;生成Fe(OH)3胶体,不是沉淀;Fe3++3H2O
Fe(OH)3(胶体)+3H+;故(2)错误;原因:生成Fe(OH)3胶体,不是沉淀,故答案为:错误;生成Fe(OH)3胶体,不是沉淀;Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(3)氢氧化铜溶于盐酸生成氯化铜和水:Cu(OH)2+2H+=2H2O+Cu2+,故(3)错误,原因:Cu(OH)2难溶,写化学式;故答案为:错误;Cu(OH)2难溶,写化学式;Cu(OH)2+2H+=2H2O+Cu2+;
(4)氢氧化钡溶液与硫酸铜溶液混合生成硫酸钡沉淀和氢氧化铜沉淀:2OH-+Cu2++SO42-+Ba2+=BaSO4↓+Cu(OH)2↓,故(4)错误;原因:生成BaSO4和Cu(OH)2两种沉淀;故答案为:错误;生成BaSO4和Cu(OH)2两种沉淀;2OH-+Cu2++SO42-+Ba2+=BaSO4↓+Cu(OH)2↓;
(5)铝与氯化铜溶液发生置换反应生成氯化铝和铜:2Al+3Cu2+=2Al3++3Cu,故(5)错误;原因为:原方程式两边电荷不守恒,故答案为:错误;原方程式两边电荷不守恒;2Al+3Cu2+=2Al3++3Cu;
(6)硫酸溶液与氢氧化钡溶液混合生成BaSO4和H2O:2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,故(6)错误,原因是:生成BaSO4和H2O比例为1:2;故答案为:错误,生成BaSO4和H2O比例为1:2;2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O;
(7)碳酸钙与硝酸反应生成硝酸钙和二氧化碳和水,离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,故(7)正确;
故答案为:正确;
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合生成碳酸钙沉淀和水,Ca(HCO3)2+2NaOH=CaCO3↓+2H2O+Na2CO3,离子方程式: Ca2+ + 2HCO3- +2OH- =CaCO3↓+ 2H2O+CO32-,故(8)错误;原因为:Ca2+参加反应生成CaCO3沉淀;故答案为:错误;Ca2+参加反应生成CaCO3沉淀;Ca2+ + 2HCO3- +2OH- =CaCO3↓+ 2H2O+CO32-。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案