题目内容
6.恒温下将4mol NH3和2mol CO2充入容积为2L的密闭容器中,发生反应2NH3(g)+CO2(g)?NH2CO2NH4(s),达到平衡时,CO2转化率为40%,若其他条件不变,将容器体积压缩至1L,达到新平衡时,NH3的浓度为( )| A. | 1.2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 2.4 mol•L-1 | D. | 3.6 mol•L-1 |
分析 因温度不变,故平衡常数K=$\frac{1}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$不变,则c2(NH3)×c(CO2)不变,由于氨气浓度与二氧化碳浓度变化趋势一致,故将容器体积压缩至1 L,达到新平衡时,NH3的浓度与原平衡相等.
解答 解:恒温下4mol NH3、2mol CO2充入容积为2L的密闭容器中,二者按物质的量2:1反应,故二者转化率相等,达到平衡时,CO2转化率为40%,则转化的NH3为4mol×40%=1.6mol,则平衡时氨气的浓度为$\frac{4mol-1.6mol}{2L}$=1.2mol/L,因温度不变,故平衡常数K=$\frac{1}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$不变,则c2(NH3)×c(CO2)不变,由于氨气浓度与二氧化碳浓度变化趋势一致,故将容器体积压缩至1 L,达到新平衡时,NH3的浓度与原平衡相等,仍为1.2mol/L,
故选:A.
点评 本题考查化学平衡有关计算,注意对平衡常数的理解与灵活应用,较好的考查学生的分析推理能力,难度中等.

练习册系列答案
相关题目
7.某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将Mg(OH)2沉淀转入蒸发皿中,加热可得MgO固体 |
8.下列实验的现象与对应结论均正确的是( )
| A. | 向某固体上滴加稀盐酸,有气泡产生一一该固体一定是碳酸盐 | |
| B. | 向某无色溶液中滴入酚酞试液,溶液变红色--该溶液一定是碱溶液 | |
| C. | 某固态化肥与熟石灰混合研磨后产生氨味--该化肥一定是铵态氮肥 | |
| D. | 把燃着的木条伸入某无色气体中,木条熄灭--该气体一定是二氧化碳 |
14. 一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )
一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )
 一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )
一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在50s~250s内的平均速率v(PCl3)=4.0×10-4mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,将容器的容积缩小一半,平衡逆向移动,化学平衡常数减小 | |
| D. | 相同温度下,起始时向容器中充入0.5 mol PCl5,重新达到平衡时,0.1 mol<n(PCl3)<0.2 mol |
18.下列说法正确的是( )
| A. | 铝与氧气在常温下不反应 | |
| B. | 铝的化学性质不活泼 | |
| C. | 常温下与氧气反应,铝的表面形成了一层致密的氧化膜 | |
| D. | 铝制容器既耐酸又耐碱 |
15.下列叙述正确的是( )
| A. | 一氧化碳的摩尔质量为28g | |
| B. | 0.5 mol OH-的质量为8.5g | |
| C. | 镁原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个钠原子的质量等于$\frac{23}{6.02×1{0}^{23}}$ |
16. 将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )
 将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )| A. | 无法给出实验中产生H2的物质的量 | |
| B. | 欲给出a的取值范围尚缺少一个条件 | |
| C. | 无法认定Mg、Al合金中$\frac{n(Mg)}{n(Al)}$的最大值 | |
| D. | 溶解“一定量Mg、Al合金”的HCl溶液的体积为90mL |
 ;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为
;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为 ;
;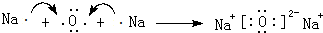 .
.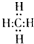 ,结构式是
,结构式是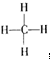 ,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)
,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)