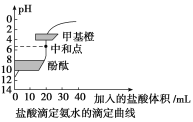
题目内容
【题目】有机物Ⅰ(英文名为Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药物,Esmolol的合成路线如图:

已知: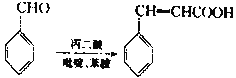
回答下列问题:
(1)C中官能团的名称有____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H的反应类型为____;B→C反应需要的试剂和条件为____。
(4)C→D中步骤①反应的化学方程式为_____。
(5)E的结构简式为____。
(6)X是F的同分异构体,则满足下列条件的X的结构有___种。
①能发生水解反应和银镜反应;
②能与FeCl3溶液发生显色反应,且苯环上有三个取代基。
(7)参照上述合成路线,设计以 、CH3OH和
、CH3OH和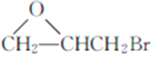 为主要原料制备
为主要原料制备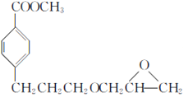 的合成路线。______
的合成路线。______
【答案】酯基、氯原子 1 取代反应 氯气,光照  +4NaOH
+4NaOH![]()
![]() +2NaCl+CH3COONa+2H2O
+2NaCl+CH3COONa+2H2O  20
20 
![]()

![]()

![]()

【解析】
根据流程图可知C7H8O为对甲基苯酚(![]() ),与乙酸(CH3COOH)反应生成B,B为
),与乙酸(CH3COOH)反应生成B,B为 ,根据C的结构可知,B在光照条件下与氯气发生取代反应生成C(
,根据C的结构可知,B在光照条件下与氯气发生取代反应生成C( ),结合反应条件,C在氢氧化钠水溶液中反应后酸化得到D(C7H6O2),则D为
),结合反应条件,C在氢氧化钠水溶液中反应后酸化得到D(C7H6O2),则D为![]() ,结合信息可知,
,结合信息可知,![]() 反应生成E,E为
反应生成E,E为 ;E在催化剂作用下与氢气加成生成F,F为
;E在催化剂作用下与氢气加成生成F,F为 ,F在浓硫酸存在时与甲醇发生酯化反应生成G,G为
,F在浓硫酸存在时与甲醇发生酯化反应生成G,G为 ,根据H的结构可知,G与
,根据H的结构可知,G与 发生取代反应生成H,加成分析解答。
发生取代反应生成H,加成分析解答。
(1)C( )中官能团有酯基、氯原子,故答案为:酯基、氯原子;
)中官能团有酯基、氯原子,故答案为:酯基、氯原子;
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。有机物Ⅰ( )中的手性碳有1个(
)中的手性碳有1个( 标记“●”的为手性碳),故答案为:1;
标记“●”的为手性碳),故答案为:1;
(3)根据流程图,结合G和H的结构可知,G→H发生取代反应;B→C反应需要的试剂和条件为氯气,光照,故答案为:取代反应;氯气,光照;
(4)C→D中步骤①为氯原子和酯基的水解反应,反应的化学方程式为 +4NaOH
+4NaOH![]()
![]() +2NaCl+CH3COONa+2H2O,故答案为:
+2NaCl+CH3COONa+2H2O,故答案为: +4NaOH
+4NaOH![]()
![]() +2NaCl+CH3COONa+2H2O;
+2NaCl+CH3COONa+2H2O;
(5)根据上述分析,E为 ,故答案为:
,故答案为: ;
;
(6)X是F( )的同分异构体,①能发生水解反应和银镜反应,说明结构中存在醛基和酯基;②能与FeCl3溶液发生显色反应,说明含有酚羟基,且苯环上有三个取代基。满足条件的X有:①苯环上含有羟基、甲基和HCOOCH2-,有10种结构;②苯环上含有羟基、乙基和HCOO-,有10种结构;共20种,故答案为:20;
)的同分异构体,①能发生水解反应和银镜反应,说明结构中存在醛基和酯基;②能与FeCl3溶液发生显色反应,说明含有酚羟基,且苯环上有三个取代基。满足条件的X有:①苯环上含有羟基、甲基和HCOOCH2-,有10种结构;②苯环上含有羟基、乙基和HCOO-,有10种结构;共20种,故答案为:20;
(7)将 分解为
分解为 和
和![]() ,再结合原料
,再结合原料 即可设计合成路线:
即可设计合成路线:
![]()

![]()

![]()
 ,故答案为:
,故答案为:
![]()

![]()

![]()
 。
。

 阅读快车系列答案
阅读快车系列答案【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
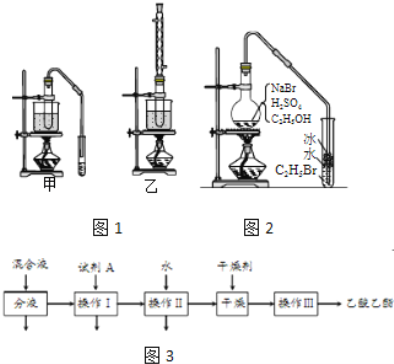
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
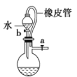
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。