题目内容
18.下列说法正确的是( )| A. | H-H键无方向性 | |
| B. | 基态C原子有两个未成对电子,所以最多只能形成2个共价键 | |
| C. | 1个N原子最多只能与4个H原子结合形成NH4+,是由共价键的饱和性所决定的 | |
| D. | 所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
分析 A.H的1s电子为球形对称;
B.基态C原子有两个未成对电子,但可杂化形成4个等同的sp3杂化轨道;
C.N最外层有5个电子,未成对电子数为3;
D.s电子在形成共价键时,没有方向性.
解答 解:A.H的1s电子为球形对称,s-s电子重叠没有方向性,则H-H键无方向性,故A正确;
B.基态C原子有两个未成对电子,但可杂化形成4个等同的sp3杂化轨道,可形成4个共价键,故B错误;
C.N最外层有5个电子,未成对电子数为3,则1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的,NH3与H+形成配位键,故C错误;
D.s电子在形成共价键时,没有方向性,则不是所有的共价键都具有方向性,如p-p电子重叠需具有方向性,故D错误;
故选A.
点评 本题考查共价键的形成及性质等,为高频考点,把握共价键的形成及电子云的重叠等为解答的关键,侧重分子结构与性质的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.已知平衡:①C2H4(g)?C2H2(g)+H2(g),②2CH4(g)?C2H4(g)+2H2(g).当温度升高时,①和②式均向右移动.
a.C(s)+2H2(g)═CH4(g)△H1; b.2C(s)+H2(g)═C2H2(g)△H2;
c.2C(s)+2H2(g)═C2H4(g)△H3;
下列有关a、b和c中△H1、△H2、△H3的大小顺序排列正确的是( )
a.C(s)+2H2(g)═CH4(g)△H1; b.2C(s)+H2(g)═C2H2(g)△H2;
c.2C(s)+2H2(g)═C2H4(g)△H3;
下列有关a、b和c中△H1、△H2、△H3的大小顺序排列正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>△H1 |
13.下列实验操作错误的是( )
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 用向上排空气法可以收集NO气体 | |
| C. | 配制硫酸亚铁溶液时,要加入适量的铁粉和稀硫酸 | |
| D. | 配制浓H2SO4和浓HNO3的混酸时,应将H2SO4慢慢加到浓HNO3中,并及时搅拌和冷却 |
10.下列关于氮及其化合物的说法正确的是( )
| A. | N2分子的结构稳定,因而氮气不能支持任何物质的燃烧 | |
| B. | 液氨汽化时要吸收大量热,因而液氨可用作制冷剂 | |
| C. | NO可用向上排空气法或者排水法收集 | |
| D. | 浓硝酸保存在棕色瓶内是因为硝酸易挥发 |
 A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法即可将它们确定.
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法即可将它们确定.
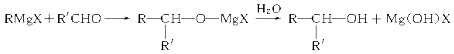
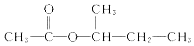 )的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
)的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.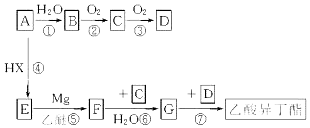
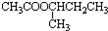 +H2O.
+H2O.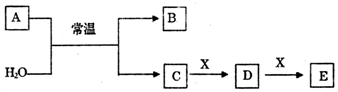
 .
.