题目内容
【题目】下表是元素周期表的一部分,针对①~⑧元素在表中的位置,回答下列问题:
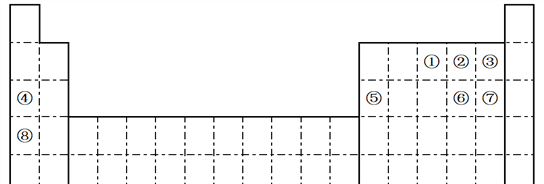
(1)⑥元素在元素周期表中的位置为________________________。
(2)写出②含有10个中子的核素的化学符号______________。
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为_______________________________________________。(用离子符号比较大小)
(4)②、③、⑥元素所形成氢化物的稳定性由强到弱的顺序是_______________________________________________。(用化学式比较强弱)
(5)请写出①的氢化物发生催化氧化的化学方程式______________________________。
(6)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应_______________________________________________。
(7)在⑥与⑦的单质中,化学性质较活泼的是___________(填化学式);可以用下列事实证明上述结论的是_____________。
a.元素⑥单质的熔点比元素⑦单质的熔点高
b.元素⑦的氢化物比元素⑥的氢化物稳定
c.元素⑦的氢化物的水溶液的酸性强于元素⑥的氢化物的水溶液的酸性
d.一定条件下⑥和⑦的单质分别与Cu反应时,⑦产物中的铜元素价态更高
【答案】 第三周期第VIA族 ![]() O O2->F->Na+>Al3+ HF >H2O>H2S 4NH3+5O2
O O2->F->Na+>Al3+ HF >H2O>H2S 4NH3+5O2![]() 4NO+6H2O 2Na2SO3+O2=2Na2SO4 Cl2 b、d
4NO+6H2O 2Na2SO3+O2=2Na2SO4 Cl2 b、d
【解析】由元素在周期表的位置,①~⑧分别为N、O、F、Na、Al、S、Cl、K;
(1) ⑥元素为硫,核电荷数为16,在元素周期表中的位置为第三周期第VIA族;正确答案:第三周期第VIA族。
(2)②为氧元素,核电荷数为8,有10个中子的核素的化学符号为![]() O ;正确答案:
O ;正确答案: ![]() O。
O。
(3)具有相同电子排布的离子中原子序数大的离子半径小,则②、③、④、⑤四种元素中,其离子半径由大到小的排列顺序为O2->F->Na+>Al3+;正确答案: O2->F->Na+>Al3+ 。
(4))非金属性越强,对应氢化物越稳定,则②③⑥元素氢化物的稳定性由强到弱的顺序为![]() ;正确答案:
;正确答案:![]() 。
。
(5)①的氢化物为氨气,氨气和氧气发生催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2![]() 4NO+6H2O ;正确答案:4NH3+5O2
4NO+6H2O ;正确答案:4NH3+5O2![]() 4NO+6H2O 。
4NO+6H2O 。
(6)由②④⑥三种元素组成的一种盐,易被氧气氧化,该盐为亚硫酸钠,具有还原性,被氧气氧化为硫酸钠,化学方程式表示变质的过程为2Na2SO3+O2=2Na2SO4 ;正确答案:2Na2SO3+O2=2Na2SO4。
(7)⑥元素形成的单质为硫,⑦元素形成的单质氯气;同一周期,原子半径越小,非金属性越强,因此氯气的活泼性大于硫;元素的非金属性的强弱与单质的熔点高低没有必然的联系,a错误;氯化氢的稳定性大于硫化氢,说明氯的非金属性大于硫,b正确;盐酸的酸性大于氢硫酸,两种酸都不是最高价含氧酸,不能比较非金属性强弱,c错误;氯气和铜反应生成氯化铜,硫与铜加热生成硫化亚铜,同样的还原剂,氯气能够把铜氧化为+2价,而硫把铜氧化为+1价,所以非金属性氯大于硫,d正确;正确答案:Cl2 ; b、d。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案