题目内容
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3 , 为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4 , 利用如图1所示的实验装置进行实验.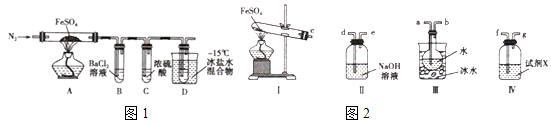
已知:①SO2熔点为﹣72℃,沸点为﹣10℃②SO3熔点为﹣16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为 , 同时有两种无色气体生成,写出该反应的化学方程式
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是 , 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品 .
实验二 探究高温分解 FeSO4生成的气体
(5)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c﹣
②试剂X的名称是
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量g.
【答案】
(1)排除装置中的空气
(2)红棕色;2FeSO4 ![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
(3)Fe2O3+6H+=2Fe3++3H2O;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
(4)在最后加一个盛碱石灰的干燥管或NaOH溶液
(5)a﹣b﹣f﹣g﹣d;品红溶液;![]()
【解析】解:(1)通入N2的目的是排除装置中的空气,所以答案是:排除装置中的空气;(2)B中有白色沉淀,可能为硫酸钡或者亚硫酸钡,有两种无色气体生成,则应为为二氧化硫和三氧化硫,硫元素化合价降低,则铁元素化合价升高为三氧化二铁,红棕色;所以答案是:红棕色;2FeSO4 ![]() Fe2O3+SO2↑+SO3↑;(3)Fe2O3与盐酸反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;将反应后所得溶液滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
Fe2O3+SO2↑+SO3↑;(3)Fe2O3与盐酸反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;将反应后所得溶液滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
所以答案是:Fe2O3+6H+=2Fe3++3H2O;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;(4)最后的D装置连接了空气,需排除空气,再D后加一个吸收二氧化碳和水的装置,以防与D中的二氧化硫反应;
所以答案是:在最后加一个盛碱石灰的干燥管或NaOH溶液;(5)①A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;
所以答案是:a﹣b﹣f﹣g﹣d;②SO2气体具有漂白性,可使品红溶液褪色,故D装置中装有品红溶液,检验二氧化硫的生成;
所以答案是:品红溶液;③第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止.若最终得到沉淀的质量为W g,沉淀为硫酸钡,依据硫元素守恒结合化学方程式定量关系可知,
2FeSO4~ | SO3~ | BaSO4 |
2 | 1 | |
n(FeSO4) |
|
已分解的硫酸亚铁质量为 ![]() ×2×152g/mol=
×2×152g/mol= ![]() g;
g;
所以答案是: ![]() .
.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案