��Ŀ����
3����һ���¶��£���2mol A��2molB ���������������ݻ�Ϊ2L��ij�ܱ������У��������·�Ӧ��3A��g��+B��g��=xC��g��+2D��g����2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4mol/L������д���пհף���1��A��ת����Ϊ60%
��2��2����������D�ķ�Ӧ����Ϊ0.2mol/��L•min��
��3��xֵ����2
��4���������Ӧ��ϵ��ѹǿ����ƽ����ϵ��C�������������䣨�������С�����䡱��
���� 2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2L=0.8mol������C��D�����ʵ�����ͬ����֪x=2����
3A��g��+B��g��=2C��g��+2D��g��
��ʼ 2 2 0 0
ת�� 1.2 0.4 0.8 0.8
ƽ�� 0.8 1.6 0.8 0.8
��1��ת����=$\frac{ת������}{��ʼ����}$��100%��
��2��v=$\frac{��c}{��t}$��
��3��������������֪������C��D�����ʵ�����ͬ������ѧ��������ͬ��
��4���÷�ӦΪ�����������ķ�Ӧ���������Ӧ��ϵ��ѹǿ��ƽ�ⲻ�ƶ���
��� �⣺2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2L=0.8mol������C��D�����ʵ�����ͬ����֪x=2����
3A��g��+B��g��=2C��g��+2D��g��
��ʼ 2 2 0 0
ת�� 1.2 0.4 0.8 0.8
ƽ�� 0.8 1.6 0.8 0.8
��1��A��ת����Ϊ$\frac{1.2}{2}$��100%=60%���ʴ�Ϊ��60%��
��2��2����������D�ķ�Ӧ����Ϊ$\frac{\frac{0.8mol}{2L}}{2min}$=0.2 mol/��L•min�����ʴ�Ϊ��0.2 mol/��L•min����
��3��������������֪x=2���ʴ�Ϊ��2��
��4���÷�ӦΪ�����������ķ�Ӧ���������Ӧ��ϵ��ѹǿ��ƽ�ⲻ�ƶ�����ƽ����ϵ��C�������������䣬�ʴ�Ϊ�����䣮
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����ƽ�����η���ת���ʼ����ʵļ���Ϊ���Ĺؼ������ط�������������Ŀ��飬ע�⣨4��Ϊ�����ѵ㣬��Ŀ�ѶȲ���

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�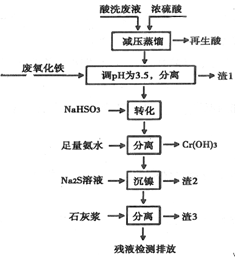
��֪��
�ٽ������ӿ�ʼ�����ͳ�����ȫʱ��pH��
| Fe3+ | Ni2+ | Cr3+ | |
| ��ʼ���� | 1.5 | 6.7 | 4.0 |
| ������ȫ | 3.4 | 9.5 | 6.9 |
��1���������к���HNO3����ȡ��ѹ�����Ŀ��Ϊ����������¶��Լ�������ķֽ⣮
��2������1����Ҫ�ɷ�Ϊ��Fe��OH��3��������������
��3����ת����ʱNaHSO3��Cr2O72-������Ӧ���������뻹ԭ�������ʵ���֮�ȣ�1��3��
��4����֪[Ni��NH3��6]2+Ϊ�ѵ����������ӣ������������ӷ���ʽΪ��[Ni��NH3��6]2++S2-=NiS��+6NH3��
��5������3����Ҫ�ɷ�ΪCaSO4��Ca��OH��2��CaF2��
��6������⣬���IJ�Һ��c��Ca2+��=0.001mol•L-1�����Һ��F-Ũ��Ϊ3.8
Mg•L-1�����ϣ�����ϡ������ϡ����ŷű�[��֪Ksp��CaF2��=4��10-11�������ŷű�Ҫ�������Ũ��С��10mg•L-1]��
 ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ����1����һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��?2NH3��g��+CO2��g����ʵ���ò�ͬ�¶��µ�ƽ���������������
| �¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ��kPa�� | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ�� ����10-3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A��2v��NH3���Tv��CO2��
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���
D���ܱ������а����������������
�ڸ��ݱ������ݣ���ʽ����25.0��ʱ��������淋ķֽ�ƽ�ⳣ��1.6��10-8��mol•L-1��3��
��ȡһ�����İ�������粒������һ�����������ܱ���������У���25���´ﵽ�ֽ�ƽ�⣮���ں�����ѹ�������������������粒����������������ӡ�������С�����䡱����
�ܰ�������立ֽⷴӦ���ʱ��H��0��
��2����֪��NH2COONH4+2H2O?NH4HCO3+NH3•H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c��NH2COO-����ʱ��仯������ͼ��ʾ��
�ݼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������0.05mol/��L•min����
����ͼ����Ϣ�����˵��ˮ�ⷴӦ�������¶����߶�����25�淴Ӧ����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա�15���


 ��
�� ��
�� +
+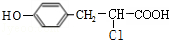 $��_{��}^{����}$
$��_{��}^{����}$ +HCl��
+HCl��
 ��д��������EDA�ĵ���ʽ
��д��������EDA�ĵ���ʽ ��
�� ������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪCH4��g��+H2O��g��?CO��g��+3H2��g����
������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪCH4��g��+H2O��g��?CO��g��+3H2��g����