题目内容
【题目】(1)用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
①Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),
向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):_____________________________。
②已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=______。
H2PO4-(aq)+H2O (l)的平衡常数K=______。
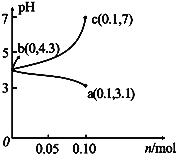
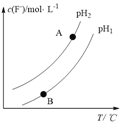
③Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
(2)处理含镍酸性废水可用电解法实现铁上镀镍,其装置如右图所示。

①电流方向是_____(填:a.碳棒→铁棒;b.铁棒→碳棒);
②中间隔室的可以得到的物质X是_______(填化学式);
③阳极的电极反应式为_______________;电解总反应的离子方程式为_______________。
【答案】 > Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 7.52×1011 < > b NaCl 4OH--4e- =O2↑+2H2O 2Ni2++4OH- -
H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 7.52×1011 < > b NaCl 4OH--4e- =O2↑+2H2O 2Ni2++4OH- -![]() O2↑+2Ni+2H2O
O2↑+2Ni+2H2O
【解析】(1)①Na2HPO4溶液呈碱性,所以HPO4-的水解程度大于电离程度,则c(H2PO4-)>c(PO43-);Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促进Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。②由已知K=
H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促进Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。②由已知K= =
= =
=![]() =
=![]() =7.52×1011。③由Ca5(PO4)3F(s) +OH-(aq)
=7.52×1011。③由Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-可得,增大OH-浓度(即增大pH),c(F-)增大,由图可得,温度相同时pH2对应的c(F-)大于pH1对应的c(F-),所以pH1<pH2;由图可得,A点温度高于B点温度,所以v(A)>v(B)。
Ca5(PO4)3(OH) (s)+F-可得,增大OH-浓度(即增大pH),c(F-)增大,由图可得,温度相同时pH2对应的c(F-)大于pH1对应的c(F-),所以pH1<pH2;由图可得,A点温度高于B点温度,所以v(A)>v(B)。
(2)①由已知:电解法实现铁上镀镍,则铁棒为阴极,电流由铁棒回到直流电源,碳棒为阳极,电流由直流电源流到碳棒,故电流方向是:b.铁棒→碳棒。②由上分析,电解过程中Na+经过阳离子交换膜进入中间隔室,Cl-经过阴离子交换膜进入中间隔室,所以中间隔室得到的物质X是NaCl。③阳极OH-放电,OH-失电子发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O;阴极Ni2+得电子发生还原反应,故电解总反应的离子方程式为:2Ni2++4OH-![]() O2↑+2Ni+2H2O。
O2↑+2Ni+2H2O。