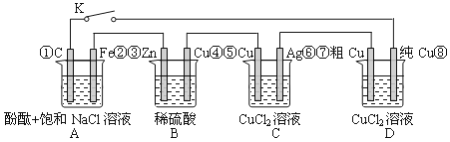
题目内容
【题目】高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙。反应的方程式如下:2Al+Fe2O3![]() 2Fe+Al2O3,下列说法不正确的是( )
2Fe+Al2O3,下列说法不正确的是( )
A. 氧化剂是Fe2O3,氧化产物是 Al2O3。
B. 被氧化的元素是铝,被还原的元素是铁。
C. 当转移的电子为0.3mol时,参加反应的铝为2.7g
D. Fe2O3既不是氧化剂又不是还原剂
【答案】D
【解析】
A、失电子化合价升高的反应物是还原剂,生成氧化产物;得电子化合价降低的反应物是氧化剂,生成还原产物;
B、失电子化合价升高的反应物是还原剂,生成氧化产物;
C、该反应中Al元素化合价由0价变为+3价,失电子化合价升高,由此计算参加反应的铝;
D、Fe2O3得电子化合价降低的反应物是氧化剂。
A、铝是失电子化合价升高的反应物是还原剂,生成的氧化产物是Al2O3,Fe2O3是得电子化合价降低的反应物,是氧化剂,生成还原产物,故A正确;
B、该反应中Al元素化合价由0价变为+3价,所以Al是还原剂、Al2O3是氧化产物,故B正确;
C、该反应中Al元素化合价由0价变为+3价,所以每1molAl参加反应时,转移电子的物质的量3mol,当转移的电子为0.3mol时,参加反应的铝为0.1mol,质量为2.7g,故C正确;
D、Fe2O3得电子化合价降低的反应物是氧化剂,还原剂是Al,故D错误;
故选D。

【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
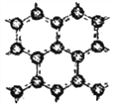
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
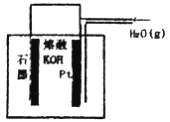
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失