题目内容
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
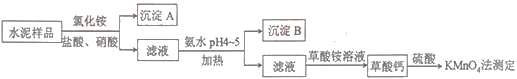
回答下列问题:
(1)沉淀A的主要成分是__。
(2)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__,请写出相应的离子方程式:__。
(3)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,实验中称取0.400g水泥样品,滴定时消耗了0.0500molL-1KMnO4溶液36.00mL。
①请配平此滴定过程中的反应。
___MnO![]() +___H++___H2C2O4——___Mn2++___CO2+___H2O
+___H++___H2C2O4——___Mn2++___CO2+___H2O
②求该水泥样品中钙的质量分数为___。
【答案】SiO2 将样品中可能存在的Fe2+氧化为Fe3+ 3Fe2++4H++NO![]() =3Fe3++NO↑+2H2O 2 6 5 2 10 8 45.0%
=3Fe3++NO↑+2H2O 2 6 5 2 10 8 45.0%
【解析】
水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物,加入氯化铵、盐酸和硝酸,由于二氧化硅与酸不反应,则得到的沉淀A为SiO2,滤液中含有Ca2+、Fe3+、Al3+、Mg2+等离子,加入氨水调节pH4~5,可生成Al(OH)3、Fe(OH)3沉淀,加热的目的是防止生成胶体而难以分离,滤液主要含有Ca2+,加入草酸铵可生成草酸钙沉淀,加入硫酸用高锰酸钾测定,发生5Ca2+~5H2C2O4~2KMnO4,根据高锰酸钾的量可计算含量。
(1)由以上分析可知沉淀A为SiO2,故答案为:SiO2;
(2)铁离子在pH较小时易生成沉淀,加入硝酸可氧化亚铁离子生成铁离子,相应的离子方程式:3Fe2++4H++NO![]() =3Fe3++NO↑+2H2O;
=3Fe3++NO↑+2H2O;
故答案为:将样品中可能存在的Fe2+氧化为Fe3+;3Fe2++4H++NO![]() =3Fe3++NO↑+2H2O;
=3Fe3++NO↑+2H2O;
(3)①在硫酸条件下,高锰酸钾将C2O42-氧化为CO2,自身被还原为MnSO4,依据氧化还原反应得失电子守恒、原子个数守恒写出反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②反应的关系式为5Ca2+~5H2C2O4~2KMnO4,
n(KMnO4)=0.0500mol·L-1×36.00mL=1.800mmol,n(Ca2+)=4.500mmol,水泥中钙的质量分数为![]() ×100%=45.00%,故答案为:45.00%。
×100%=45.00%,故答案为:45.00%。