题目内容
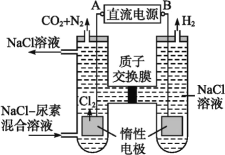
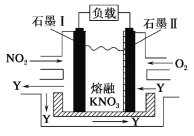
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
【答案】B
【解析】
石墨Ⅱ通入O2,则此电极为原电池的正极,则石墨Ⅰ为负极。依据电极原料,可确定发生的反应为4NO2+O2==2N2O5,则负极反应为4NO2-4e-+4NO3-==4N2O5,正极反应为O2+4e-+2N2O5==4NO3-。
A.由以上分析知,放电时,石墨Ⅰ为负极,则NO![]() 向石墨Ⅰ电极迁移,A不正确;
向石墨Ⅰ电极迁移,A不正确;
B.电池放电时,依据以上分析,电池总反应式为 4NO2+O2==2N2O5,B正确;
C.石墨Ⅱ附近发生的反应为O2+4e-+2N2O5==4NO3-,C不正确;
D.负极反应为4NO2-4e-+4NO3-==4N2O5,当外电路通过 4 mol e-,负极上共产生 4mol N2O5,D不正确;
故选B。

练习册系列答案
相关题目