��Ŀ����
I��1���ڵ��۵⻯����Һ��ͨ�����������������ῴ����Һ����ɫ����Ӧ�����ӷ���ʽ�� ��
��2���ڵ�͵����γɵ���ɫ��Һ��ͨ��SO2���壬������ɫ����ʧ����Ӧ�����ӷ����� ��
��3���Աȣ�1���ͣ�2��ʵ�����õĽ������Cl ��I
��I SO2����ԭ����ǿ����˳������Ϊ ��
SO2����ԭ����ǿ����˳������Ϊ ��
II ��4�� ��ȥ�����л������۵��Լ��� �����ӷ���ʽΪ
��5�� 1mol����������2mol̼�����ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ���������
��2���ڵ�͵����γɵ���ɫ��Һ��ͨ��SO2���壬������ɫ����ʧ����Ӧ�����ӷ����� ��
��3���Աȣ�1���ͣ�2��ʵ�����õĽ������Cl
 ��I
��I SO2����ԭ����ǿ����˳������Ϊ ��
SO2����ԭ����ǿ����˳������Ϊ �� II ��4�� ��ȥ�����л������۵��Լ��� �����ӷ���ʽΪ
��5�� 1mol����������2mol̼�����ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ���������
��1��2I- + CI2 = I2 + 2CI- ��2�� I2 + SO2 + 2H2O = 4H+ + SO42- + 2I- ��3��SO2�� I - ��CI-
��4��NaOH��Һ 2Al+ 2OH - + 2H2O = 2AlO2- + 3H2 �� ��5�� Na2CO3
��4��NaOH��Һ 2Al+ 2OH - + 2H2O = 2AlO2- + 3H2 �� ��5�� Na2CO3
�����������1���ڵ��۵⻯����Һ��ͨ����������������Ӧ��2KI-+ Cl2 = I2 + 2KCl. I2�����۱�Ϊ��ɫ����Ӧ�����ӷ���ʽ2I- + CI2 = I2 + 2CI-����2���ڵ�͵����γɵ���ɫ��Һ��ͨ��SO2���壬������Ӧ��I2+ SO2+2H2O=2HI+H2SO4��������ɫ����ʧ����Ӧ�����ӷ���ʽΪI2 + SO2 + 2H2O = 4H+ + SO42- + 2I- .��3������������ԭ��Ӧ�Ĺ��ɣ������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ������Ի�ԭ�ԣ�SO2�� I -��CI- ����4��Fe��Al���DZȽϻ��õĽ��������ܰ����е����û���������Al����ǿ����Һ������Ӧ����Fe���ܡ��ʳ�ȥ�����л������۵��Լ���NaOH��Һ����Ӧ�����ӷ���ʽ��2Al+ 2OH - + 2H2O = 2AlO2- + 3H2 ��. ��5�� 2NaHCO3
 Na2CO3+ CO2��+ H2O��2mol��NaHCO3���ȷֽ�õ�1mol CO2��1molH2O . 1mol H2O������Ӧ2Na2O2+2H2O=4NaOH+O2��������Na2O21mol ����2mol NaOH .�ٷ�����Ӧ2NaOH+ CO2= 2Na2CO3 +H2O���ۺ������൱�ڷ���2Na2O2+2CO2=2Na2CO3+O2����Na2O21mol,����Na2CO31mol�������õ��Ĺ���ΪNa2CO3��
Na2CO3+ CO2��+ H2O��2mol��NaHCO3���ȷֽ�õ�1mol CO2��1molH2O . 1mol H2O������Ӧ2Na2O2+2H2O=4NaOH+O2��������Na2O21mol ����2mol NaOH .�ٷ�����Ӧ2NaOH+ CO2= 2Na2CO3 +H2O���ۺ������൱�ڷ���2Na2O2+2CO2=2Na2CO3+O2����Na2O21mol,����Na2CO31mol�������õ��Ĺ���ΪNa2CO3��
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
 Ce��
Ce�� Ce��
Ce��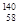 Ce��
Ce�� Ce���ǻ���Ϊͬ��������
Ce���ǻ���Ϊͬ�������� CeI4 + 2H2��
CeI4 + 2H2��