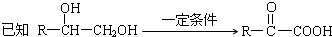
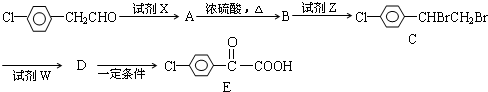
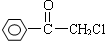题目内容
下列反应没有涉及原电池的是( )
| A、生铁投入稀盐酸中 |
| B、铜片与银片用导线连接后,同时插入FeCl3溶液中 |
| C、纯锌投入硫酸铜溶液中 |
| D、含铜的铝片投入浓硫酸中 |
考点:原电池和电解池的工作原理
专题:
分析:根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此分析.
解答:
解:A、生铁投入稀盐酸中,Fe能够与盐酸反应,生铁中含有碳,能够形成铁碳原电池,故A错误;
B、Cu能够与三价铁离子反应,在氯化铁溶液中形成铜银原电池,故B错误;
C、Zn能够置换出铜,在硫酸铜溶液中形成锌铜原电池,故C错误;
D、铝在浓硫酸中钝化,不能继续反应,不能形成原电池,故D正确;
故选D.
B、Cu能够与三价铁离子反应,在氯化铁溶液中形成铜银原电池,故B错误;
C、Zn能够置换出铜,在硫酸铜溶液中形成锌铜原电池,故C错误;
D、铝在浓硫酸中钝化,不能继续反应,不能形成原电池,故D正确;
故选D.
点评:本题考查了原电池的构成条件,注意这几个条件必须同时具备,缺一不可,题目难度不大.

练习册系列答案
相关题目
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
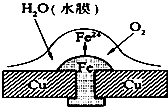

| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |
下列说法错误的是( )
| A、已知2NO2?N2O4加压后颜色先变深后变浅 |
| B、在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小 |
| C、在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L |
| D、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是⑤⑥⑦⑧. ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、溶液中一定不含Cu2+ |
| D、剩余固体中一定含Cu |
造成硫酸型酸雨的主要物质是( )
| A、NO2 |
| B、SO2 |
| C、CF2Cl2 |
| D、CO |
已知离子R2-的原子核内有n个中子,R原子的质量数为m.则W克离子R2-共含有的电子为( )
A、
| ||
B、
| ||
C、
| ||
D、
|