题目内容
(8分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
(1)AlO2-[或Al(OH)4-] (1分)
(2)Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑] (2分)。
(3)①③④ (2分) (4)Al3++3NH2·H2O═Al(OH)3↓+3NH4+ (2分)。可溶性锌盐与氨水反应产生的Zn(OH)2可溶液过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制(1分)
解析试题分析:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,溶液中铝元素的存在形式为AlO2-或Al(OH)4-。
(2)由于锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。实验可依据铝与氢氧化钠溶液反应得出锌与氢氧化钠溶液反应的方程式,即为Zn+2NaOH=Na2ZnO2+H2↑或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑。
(3)硫酸铝滴入到氢氧化钠溶液中,开始没有白色沉淀产生。但氢氧化钠完全反应后再滴加硫酸铝开始出现白色沉淀氢氧化铝。如果把氢氧化钠溶液滴入到硫酸铝溶液中立即出现白色沉淀氢氧化铝,可以鉴别;由于氢氧化铝不能溶于弱碱氨水中,因此硫酸铝和氨水不论怎么相互滴加,都是产生白色沉淀,不能鉴别;由于氢氧化锌的性质类似于氢氧化铝,所以硫酸锌和氢氧化钠溶液相互滴加顺序不同时实验现象不同,可以鉴别;由于氢氧化锌能溶于氨水中,所以硫酸锌滴入到氨水中开始得不到沉淀,而氨水滴入到硫酸锌溶质中立即出现白色沉淀氢氧化锌,实验现象不同,可以鉴别,答案选①③④。
(4)由于氢氧化铝不能溶于弱碱氨水中,因此可溶性铝盐与氨水反应的离子方程式为Al3++3NH2·H2O=Al(OH)3↓+3NH4+;由于氢氧化锌钠溶于弱碱氨水中,因此可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制,所以实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌。
考点:考查铝、锌、氢氧化铝、氢氧化锌的性质;物质的鉴别与制备

以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下: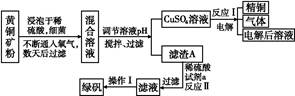
回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
(3)写出反应Ⅰ的化学方程式: 。
(4)试剂a为 。
(5)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 (写操作名称)。
(6)生产过程中,除了试剂a、H2O可以循环使用外,还可循环使用的物质有 (写化学式)。
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。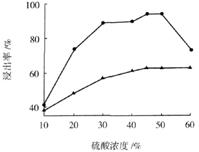

(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
| 物质 | Ca(OH)2 | CaSO4 | Na2SO4 |
| 溶解度/g | 0.153 | 0.258 | 19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
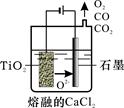
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为

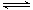 Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。



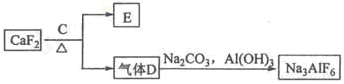

 b变化过程的离子方程式 。
b变化过程的离子方程式 。