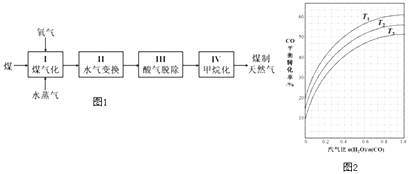
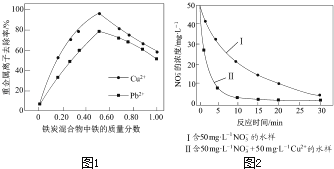
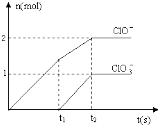
题目内容
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D
【答案】D
【解析】解:A.铁与稀盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+═Fe2++H2↑,提供的离子方程式错误,评价不合理,故A错误;
B.大理石溶于醋酸的反应,碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO﹣ , 题中评价不合理,故B错误;
C.FeCl3溶液“腐蚀”铜箔,二者反应生成氯化亚铁和硫化铜,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+ , 题中离子方程式错误,评价不合理,故C错误;
D.NH4HCO3溶液与过量KOH浓溶液共热,氢氧化钾过量,题中漏掉了碳酸氢根离子的反应,正确的离子方程式为:2OH﹣+NH4++HCO3﹣ ![]() CO32﹣+NH3↑+2H2O,该评价合理,故D正确;
CO32﹣+NH3↑+2H2O,该评价合理,故D正确;
故选D.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】在100℃时,将0.40mol NO2气体充入2L的密闭容器中,发生如下反应:2NO2(g)N2O4(g)△H<0.监测反应获得如表数据:下列说法正确的是( )
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
A.0~20 s内,v(NO2)=0.005 mol?L﹣1?s﹣1
B.59 s时,c(NO2)一定大于0.12 mol?L﹣1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K> ![]()
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol