题目内容
下列说法中正确的是
A.氯化钠的电子式是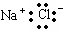 |
| B.按照不同分类标准,KAl(SO4)2属于强电解质、硫酸盐、酸式盐 |
| C.标准状况下,2.24 L C2H6中含有0.6 NA对共用电子对 |
| D.Mg、F2、H2O2依次是只有还原性、只有氧化性、既有氧化性也有还原性 |
D
解析试题分析:A、氯化钠是离子化合物要写出阴阳离子形式,错误; B、不是,酸式盐要电离出氢离子。C.标准状况下,2.24 L C2H6中含有0.7 NA对共用电子对,D、从化合价角度分析,金属无负价,氟没有正价,H2O2中氧元素化合价可以升高也可以降低;
考点:考查电子式,物质的分类和气体摩尔体积,物质的氧化性还原性等知识。

练习册系列答案
相关题目
下列叙述中正确的是
| A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B.标准状况下,28g CO与22.4LSO3所含分子数相等 |
| C.5.6g铁粉与足量氯气充分反应,有0.2mol电子转移 |
| D.等物质的量的CH5+和NH2-所含电子数相等 |
化学科学需要借助化学专用语言来描述。下列有关化学用语表示正确的是
A.丙烷的球棍模型: |
B. 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
| C.乙酸的分子式:CH3COOH |
| D.氧化钠的化学式:Na2O2 |
Fe2O3、ZnO、CuO的固体混合粉末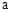 克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为( )
克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为( )
| A.7.41 | B.3.59 | C.3.21 | D.2.46 |
若NA表示阿伏加德罗常数,下列说法正确的是
| A.Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 |
| B.常温常压下,92 g NO2和N2O4的混合气体中含有的分子数目为2NA |
| C.一定条件下,密闭容器充入1molN2和3molH2充分反应,转移电子的数目为6NA |
| D.FeCl3溶液中,若Fe3+数目为NA,则Cl—数目大于3NA |
设NA为阿伏加德罗常数的值。下列说法一定正确的是
| A.9.2 g C7H8和C3H8O3的混合物中所含氢原子总数为0.8 NA |
| B.标准状况下,11.2 L C2H5OH中所含的分子数为0.5 NA |
| C.将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1 NA个Fe(OH)3胶粒 |
| D.0.1 mol Na2O2参加反应转移的电子数目是0.2 NA |
下列化学用语表示正确的是
| A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6 kJ/mol |
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO一+H2O RCOOH+OH- RCOOH+OH- |
C.实验室制氯气的离子方程式:MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH CH3CO18OC2H5+H2O CH3CO18OC2H5+H2O |
NA为阿伏伽德罗常数,下列叙述错误的是( )
| A.1mol乙醇中含有C—H键的数目为6 NA |
| B.46gNO2和N2O4混合气体中含有原子总数为3NA |
| C.足量Na 与1 mol O2反应,,转移电子可能为4NA个 |
D.常温下,1L 0.1 0mol.L-1的 溶液中氮原子数为0.2 溶液中氮原子数为0.2 |