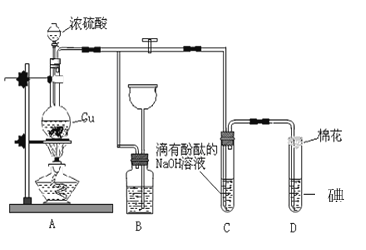
��Ŀ����
����Ŀ����ˮ�ĵ���ƽ���У�c(H��)��c(OH��)�Ĺ�ϵ��ͼ��ʾ��
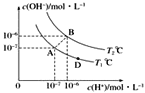
(1)A��ˮ�����ӻ�Ϊ1��10��14��B��ˮ�����ӻ�Ϊ___�����ˮ�����ӻ��仯��ԭ����________��
(2)����˵����ȷ����___��
a��A��B��D���㴦Kw�Ĵ�С��ϵ��B>A>D b��AB������������Һ��������
c��B����Һ��pH��6�������� d��ͼ���¶�T1>T2
(3)T2��ʱ��������Һ�еμ����ᣬ�ܷ�ʹ��ϵ����B��λ�ã�___Ϊʲô��___________��
(4)T2��ʱ����������c(H��)��5��10��4mol��L��1������ˮ���������c(H��)��____��
���𰸡�1��10��12 ˮ�ĵ���Ҫ���ȣ��¶����ߣ�ˮ�ĵ���̶��������ӻ����� b �� ��������c(H��)��c(OH��)�����Բ����ܴ���B��λ�� 2��10��9mol��L��1
��������
(1)���������е����ݣ�����֪��B��ˮ�����ӻ�Ϊ1��10-12��ˮ�ĵ�����������ȹ��̣��¶�Խ�ߣ�ˮ�����ӻ���Խ��
��Ϊ��1��10��12 ��ˮ�ĵ���Ҫ���ȣ��¶����ߣ�ˮ�ĵ���̶��������ӻ�����
(2) a��ͼ��A��D�������ͬһ�����ϣ���Kw��ȣ���a����
b��AB������������c(H+ )=c(OH- )�������ԣ���b��ȷ��
c��B��c(H+ )=c(OH- )�������ԣ���c����
d��A��B��Kw��ǰ��С�ں��ߣ��¶�Խ�ߣ�ˮ�����ӻ�����Խ������ߴ������¶ȸߣ���T1С��T2����d����
��ѡb��
(3) T2��ʱ��������Һ�еμ����ᣬ c(H+ )��c(OH- )�������ܴ���B��λ�á�
��Ϊ������������c(H��)��c(OH��)�����Բ����ܴ���B��λ�ã�
(4) T2��ʱ����Kw=c(H+)��c(OH- )�ɵ�c(H+ )ˮ=![]() mol��L��1=2��10-9 mol��L��1��
mol��L��1=2��10-9 mol��L��1��
����2��10��9mol��L��1��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�����Ŀ��ijѧ����NaOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ����������ʵ�飺ȡ15 mL������Һ��250 mL��ƿ�У�����1~2�η�̪��Һ����NaOH����Һ�ζ��������������������ظ�2�Ρ�
��1����գ���������С����ѡ����ƫ��������ƫ����������Ӱ������
��װ��ζ���������ˮϴ�Ӻ�ֱ�Ӽ���NaOH����Һ���еζ��������Һ��Ũ��________��
����ƿ������ˮϴ�Ӻ�ˮδ��������ζ�ʱ��ȥNaOH����Һ�����________��
�۵ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�________________________��
���ζ��ﵽ�յ�ʱ����ָ̪ʾ����________ɫ���________ɫ��
��2���ζ�������±���ʾ��
�ζ����� | ����Һ�����/mL | ����������Һ�����/ mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
��NaOH����Һ��Ũ��Ϊ0.1010 mol/L�������Һ��Ũ��Ϊ________��