题目内容
【题目】原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大。已知X是迄今为止形成化合物最多的元素。Y原子最外层电子数与核外电子总数之比为3∶4。M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物。Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小。W是第Ⅷ族元素中原子序数最小的元素。据此回答:
(1)写出W在周期表中位于哪一区:_____________,X与N按1:4形成的化合物中,X和N之间的σ键的类型:____________;
(2)用电子式表示Z与M形成化合物的过程_____________________________________;
(3)X、Y、M的电负性由小到大的顺序是____________________填元素符号);N3一与X、Y形成的一种化合物互为等电子体,则N3一的空间构型为________________;
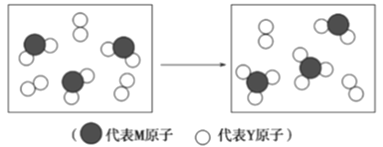
(4)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:____________________
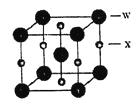
(5)X和W所形成的某种晶体结构如右图所示,写出: 基态W3+离子的结构示意图:_____________;
(6)N元素基态原子核外电子有_______种空间运动状态?
【答案】 d sp3-pб键 ![]() C<S<O 直线形
C<S<O 直线形 ![]()
![]() 9
9
【解析】(1)元素周期表的分类、化学键类型,X是迄今为止形成化合物最多的元素,即X为C,Y原子最外层电子数与核外电子总数之比为3:4,即Y为O,M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物,即M为S,Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小,Z为Na,N为Cl,W是第Ⅷ族元素中原子序数最小的元素,推出W为Fe,(1)Fe位于VIII族,属于d区;形成的化合物是CCl4,碳原子杂化类型为sp3杂化,形成的σ键类型是sp3-pσ键;(2)考查用电子式表示形成过程,形成的化合物是Na2S,即形成过程是![]() ;(3)考查电负性的规律、等电子体,同主族从上到下电负性减弱,即O>S,C与S形成CS2,其中C显+4价,S显-2价,因此S的电负性大于C,电负性由小到大的顺序是C<S<O;根据等电子体的定义,X、Y形成的化合物与N3-互为等电子体的是CO2,CO2的空间构型为直线型,等电子体具有相似的化学键特征,因此N3-的空间构型为直线型;(4)考查化学反应方程式的书写,根据转化关系应是SO2转化成SO3的过程,即反应方程式为2SO2+O2
;(3)考查电负性的规律、等电子体,同主族从上到下电负性减弱,即O>S,C与S形成CS2,其中C显+4价,S显-2价,因此S的电负性大于C,电负性由小到大的顺序是C<S<O;根据等电子体的定义,X、Y形成的化合物与N3-互为等电子体的是CO2,CO2的空间构型为直线型,等电子体具有相似的化学键特征,因此N3-的空间构型为直线型;(4)考查化学反应方程式的书写,根据转化关系应是SO2转化成SO3的过程,即反应方程式为2SO2+O2![]() 2SO3;(5)考查化学用语,Fe位于第四周期VIII族,26号元素,Fe3+结构示意图为
2SO3;(5)考查化学用语,Fe位于第四周期VIII族,26号元素,Fe3+结构示意图为 ;(6)考查原子轨道,Cl核外电子排布式为1s22s22p63s23p5,s能级有1个原子轨道,p能级有3个原子轨道,应有9种空间运动状态。
;(6)考查原子轨道,Cl核外电子排布式为1s22s22p63s23p5,s能级有1个原子轨道,p能级有3个原子轨道,应有9种空间运动状态。


