��Ŀ����
����Ŀ�������ǻ������������ֺ������绢������������������Ϊ���Ͻ��ά���������ӷϷ�(��Ҫ�ɷ�ΪV2O5��Fe2O3��SiO2��)�л���V2O5��һ�ֹ�����������ͼ��ʾ: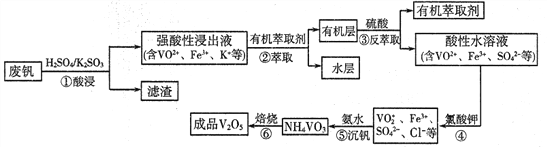
��֪:�����������еı仯���̿ɼ�Ϊ:Rn+(ˮ��)+nHA(�л���)![]() RAn(�л���)+nH+(ˮ��)(ʽ��Rn+��ʾVO2+��Fe3+��HA��ʾ�л���ȡ��)��
RAn(�л���)+nH+(ˮ��)(ʽ��Rn+��ʾVO2+��Fe3+��HA��ʾ�л���ȡ��)��
�ش���������:
��1����������������з���������ԭ��Ӧ�Ļ�ѧ����ʽΪ______________��
��2����ȡʱӦ�����������������___________________��
��3���������з�Ӧ�����ӷ���ʽΪ___________________��
��4��������25��Cʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
ͨ���������ݷ�������ʵ�������У����м��백ˮ��������Һ�����pH��ΧΪ______��
�����백ˮ������ҺpH=2���������ʴﵽ93%�Ҳ�����Fe(OH)3���������ʱ��Һ��c(Fe3+)<_____mol/L(��25����㣬25��ʱKsp[Fe(OH)3]=2.6��10-39)��
��5��V2O5�������������ǿ������Һ����VO2+��ʽ���ڣ�VO2+����ǿ�����ԣ��ܽ�I-����ΪI2����������ԭΪVO+����V2O5������ᷴӦ�����ӷ���ʽΪ_________________��
��6��Ϊ��߷��Ļ����ʣ��������������ν��У��������������ǿ���Խ���Һ����c(VO2+)=amol/L������������ÿ����һ�Σ�VO2+��ȡ��Ϊ80%��4�β�������ǿ���Խ���Һ����c(VO2+)=_______mol/L(��ȡ��=![]() )
)
���𰸡� V2O5+K2SO3+2H2SO4=K2SO4+2VOSO4+2H2O ������кͲ������ᣬʹƽ����RAn�ƶ�����߷�����ȡ�� ClO3-+6VO2++3H2O=6VO2++Cl-+6H+ 1.7~1.8 2.6��l0-3 V2O5+6H++4I-=2VO++2I2+3H2O 1.6a��l0-3
���������Ϸ�(��Ҫ�ɷ�ΪV2O5��Fe2O3��SiO2��)�����������������������˵õ�ǿ���Խ���Һ��VO2+��Fe3+��K+�������л���ȡ����ȡ��Һ�õ��л����ˮ�㣬���л����м�������Rn+(ˮ��)+nHA(�л���)RAn(�л���)+nH+(ˮ��)��ƽ��������У�����ȡ�õ�������Һ��VO2+��Fe3+��SO42-���������������VO2+����VO2+���õ���Һ�к�VO2+��Cl-��Fe3+��SO42-�����백ˮ��������ҺpH=2���������ʴﵽ93%�Ҳ�����Fe(OH)3�����������õ�NH4VO3�����յõ���ƷV2O5��
(1)�������������з���������ԭ��Ӧ��V2O5��������Һ���������������������أ���������������ԭΪVOSO4����Ӧ�Ļ�ѧ����ʽΪ��V2O5+K2SO3+2H2SO4=K2SO4+2VOSO4+2H2O���ʴ�Ϊ��V2O5+K2SO3+2H2SO4=K2SO4+2VOSO4+2H2O��
(2)��ȡʱӦ������������������кͲ������ᣬʹƽ��������RAn�ķ����ƶ�����߷�����ȡ�ʣ��ʴ�Ϊ��������кͲ������ᣬʹƽ��������RAn�ƶ�����߷�����ȡ�ʣ�
(3)������з�Ӧ�����������VO2+��������VO2+����Ӧ�����ӷ���ʽΪ��ClO3-+6VO2++3H2O=6VO2++Cl-+6H+���ʴ�Ϊ��ClO3-+6VO2++3H2O=6VO2++Cl-+6H+��
(4)���ݱ������ݿ�֪��pH��1.7~1.8֮��ʱ������������ߣ�����ݼ��백ˮ������ҺpH=2��c(H+)=10-2mol/L��c(OH-)=![]() =10-12mol/L���������ʴﵽ93%�Ҳ�����Fe(OH)3������25��ʱKsp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.6��10-39��c(Fe3+)=
=10-12mol/L���������ʴﵽ93%�Ҳ�����Fe(OH)3������25��ʱKsp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.6��10-39��c(Fe3+)= =2.6��l0-3 ���ʴ�Ϊ��1.7~1.8��2.6��l0-3��
=2.6��l0-3 ���ʴ�Ϊ��1.7~1.8��2.6��l0-3��
(5)VO2+����ǿ�����ԣ��ܽ�I-����ΪI2����������ԭΪVO+����V2O5������ᷴӦ�����ӷ���ʽΪ��V2O5+6H++4I-=2VO++2I2+3H2O���ʴ�Ϊ��V2O5+6H++4I-=2VO++2I2+3H2O��
(6)ǿ���Խ���Һ��c(VO2+)=amol/L������ں͢�ÿ����һ�Σ�VO2+��ȡ��Ϊ80%��4�β�������ǿ���Խ���Һ����c(VO2+)������ȡ��80%��ʣ����Һ��20%���Ĵ���ȡ����ȡ����=![]() ��100%������õ�ʣ����Һ��c(VO2+)=a��20%��20%��20%��20%=1.6a��l0-3���ʴ�Ϊ��1.6a��l0-3��
��100%������õ�ʣ����Һ��c(VO2+)=a��20%��20%��20%��20%=1.6a��l0-3���ʴ�Ϊ��1.6a��l0-3��

 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�����Ŀ��ijѧ����0.1000molL��1�������Һ�ⶨij�ռ���Ʒ�Ĵ��ȣ����ʲ������ᷴӦ����ʵ�鲽�����£�
��1�����ƴ���Һ����2.50g�����������ʵĹ����ռ���Ʒ����500mL��Һ�����õIJ������������ձ�����ͷ�ιܡ��������⣬����Ҫ ��
��2���ζ��� I��������ˮϴ����ʽ�ζ��ܣ�������ע���������Һ����0���̶�������
�̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壬����Һ������0����0���̶������£�����¼����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������2�η�̪��Һ
�����ñ�Һ�ζ����յ㣬��¼�ζ���Һ�������
�������ζ��������д�����ǣ����ţ� �� �ô�������ᵼ�²ⶨ������ƫ����ƫС������Ӱ�족����
�ڲ�����еζ�ʱ�۾�Ӧ���жϵζ��յ�������� ��
��������II�����Ӷ�����������и��Ӷ��������ʹ�ⶨ������ƫ����ƫС������Ӱ�족����
��3������ȷ��������й����ݼ�¼���£�
�ζ����� | ����Һ��� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 20.00 | 0.20 | 20.38 |
�ڶ��� | 20.00 | 4.00 | 24.20 |
������ | 20.00 | 2.38 | a |
��a�Ķ�����ͼ��ʾ����a=��
���ռ���Ʒ�Ĵ���Ϊ%��