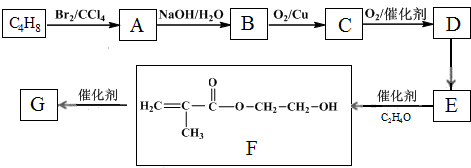
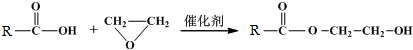
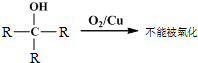
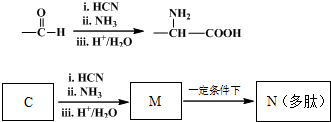
题目内容
已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4.一般而言,该式中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最弱的是( )
| A、HMnO4 |
| B、H2SeO3 |
| C、H3BO3 |
| D、H3PO4 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,将选项中含氧酸改写成XOm(OH)n形式,根据非羟基氧原子数目判断.
解答:
解:含氧酸可用通式XOm(OH)n来表示,式中m大的是强酸,m小的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,
A.HMnO4可以改写为MnO3(OH)1,非羟基氧原子数目为3;
B.H2SeO3可以改写为SeO1(OH)2,非羟基氧原子数目为1;
C.H3BO3可以改写为B(OH)3,非羟基氧原子数目为0;
D.H3PO4可以改写为PO1(OH)3,非羟基氧原子数目为1;
HClO4中非羟基氧原子数目最多,酸性最强,H3BO3中非羟基氧原子数目最少,酸性最弱,
故选C.
A.HMnO4可以改写为MnO3(OH)1,非羟基氧原子数目为3;
B.H2SeO3可以改写为SeO1(OH)2,非羟基氧原子数目为1;
C.H3BO3可以改写为B(OH)3,非羟基氧原子数目为0;
D.H3PO4可以改写为PO1(OH)3,非羟基氧原子数目为1;
HClO4中非羟基氧原子数目最多,酸性最强,H3BO3中非羟基氧原子数目最少,酸性最弱,
故选C.
点评:本题属于信息给予题,正确理解题中所给信息是解本题关键,根据非羟基氧原子数目多少来确定酸性强弱即可,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
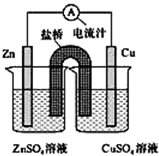 如图为一原电池的装置示意图,下列说法不正确的是( )
如图为一原电池的装置示意图,下列说法不正确的是( )| A、原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| B、原电池工作时,电流由铜极流经电流计流向锌极 |
| C、原电池工作时,盐桥中K+移向CuSO4溶液 |
| D、如果将Cu电极与Zn电极互换,电流计指针反向偏转 |
下列各组离子,能在水溶液中大量共存的是( )
| A、OH-、K+、Fe3+、NO3- |
| B、HCO3-、OH-、Cl-、K+ |
| C、Mg2+、NO3-、H+、Al3+ |
| D、SO42-、Ag+、NH4+、Cl- |
下列各图所表示的反应是吸热反应的是( )
A、 反应过程 |
B、 反应过程 |
C、 反应过程 |
D、 反应过程 |
氧化还原反应在生产、生活中具有广泛的用途.下列事例不属于氧化还原反应的是( )
| A、工业炼铁 | B、食醋除水垢 |
| C、食物消化 | D、木柴生火 |
下列说法中正确的是( )
| A、2mol CH4的质量和O2的摩尔质量都是32g |
| B、1mol任何气体中都含有相同的原子数 |
| C、0.5molNaCl约含有6.02×1023个离子 |
| D、1mol/LKCl溶液中含有溶质1mol |
下列变化必须加还原剂才能发生的是( )
| A、Na2CO3→NaHCO3 | ||
| B、H2O2→H2O | ||
| C、Cu→CuO | ||
D、MnO
|
下列与化学反应能量相关的叙述正确的是( )
| A、反应物的总能量一定高于生成物的总能量 |
| B、一个反应是放热还是吸热取决于该反应的发生是否需要加热 |
| C、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| D、若旧键断裂吸收的总能量小于新键形成放出的总能量,则该反应为吸热反应 |