题目内容
【题目】碳酸盐在无机试剂制备中应用广泛。某研究小组用如下两种方法制备FeCO3。已知: FeCO3 是白色固体,难溶于水。
I.研究小组用炼铁厂的铁矾渣制备FeCO3,铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等。
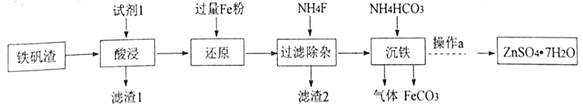
(1)试剂1是过量的_______,滤渣 2的成分是__________ (写化学式);
(2)“沉铁”发生反应的离子方程式是____________;
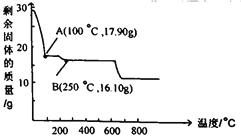
(3)沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),“操作a”是__,取28.70g皓矾(ZnSO4·7H2O)加热,剩余固体的质量变化如图,100°C时所得固体的化学式____。
II.研究小组又采用如下装置制取FeCO3 (C后及夹持装置略)。操作的关键是向Na2CO3溶液(pH=12.11)通入一段时间CO2至溶液pH为7,再滴加一定量FeSO4溶液,产生白色沉淀。
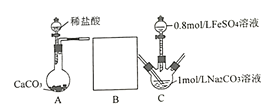
(1)画出装置B______________,B中所用试剂为______________;
(2)先向1mol/L Na2CO3溶液中通入CO2的目的是_________________________;
(3)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是_______________(不考虑操作不当引起的误差)。
【答案】H2SO4 MgF2、CaF2、Fe Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 蒸发浓缩、冷却结晶 ZnSO4H2O  饱和NaHCO3溶液 排除装置中的空气,降低溶液中OH-的浓度,防止生成Fe(OH)2 乳酸根中的羟基被KMnO4氧化,也消耗了KMnO4
饱和NaHCO3溶液 排除装置中的空气,降低溶液中OH-的浓度,防止生成Fe(OH)2 乳酸根中的羟基被KMnO4氧化,也消耗了KMnO4
【解析】
I.用过量的稀硫酸溶解铁矾渣(主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等),SiO2不溶,过滤得到的滤渣I主要是SiO2,滤液为含有K+、Fe3+、Zn2+、Ca2+、Mg2+的酸性溶液,加入铁粉,发生反应2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,再加入NH4F使Ca2+、Mg2+离子沉淀,过滤,滤渣II含有过量的铁粉、CaF2、MgF2,滤液主要含有Fe2+、Zn2+,再加入NH4HCO3沉淀Fe2+,生成FeCO3和CO2气体,得到的滤液经蒸发浓缩、冷却结晶,再经过过滤、 洗涤、干燥,得到皓矾(ZnSO47H2O) ,据此分析解答;
II.(1)装置A反应制得的CO2气体中含有氯化氢气体,影响后续制取实验,据此分析;
(2)碳酸钠溶液碱性强,溶液中c(OH-)大,就会出现生成氢氧化亚铁与制备的FeCO3成为竞争反应,而导致制备的FeCO3纯度低,NaHCO3溶液碱性弱,制得FeCO3纯度高;
(3)根据乳酸[CH3CH(OH)COOH]的结构简式,乳酸中醇羟基,具有醇的性质,可与高锰酸钾溶液反应,据此分析。
I.(1)根据分析,试剂1是过量的硫酸(H2SO4),滤渣2的成分是铁粉(Fe)、CaF2、MgF2;
(2)“沉铁”发生反应的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),结合分析,“操作a”是蒸发浓缩、冷却结晶;
皓矾(ZnSO47H2O)受热易分解,在不同的温度下分解可生成ZnSO4H2O或ZnSO4或ZnO,产物不同;28.70g皓矾的物质的量为:n((ZnSO47H2O)=![]() =0.1mol,不论分解产物是什么,根据锌元素守恒,物质的量为0.1mol,因此生成0.1molZnSO4H2O的质量=0.1mol ×179g/mol=17.90g;生成0.1molZnSO4的质量=0.1mol ×161g/mol=16.10g;生成0.1molZnO的质量=0.1mol ×81g/mol=8.10g;根据上述100°C时所得固体A的质量为17.90g,生成的固体为ZnSO4H2O;
=0.1mol,不论分解产物是什么,根据锌元素守恒,物质的量为0.1mol,因此生成0.1molZnSO4H2O的质量=0.1mol ×179g/mol=17.90g;生成0.1molZnSO4的质量=0.1mol ×161g/mol=16.10g;生成0.1molZnO的质量=0.1mol ×81g/mol=8.10g;根据上述100°C时所得固体A的质量为17.90g,生成的固体为ZnSO4H2O;
II.(1)装置A反应制得的CO2气体中含有氯化氢气体,影响后续制取实验,通入C装置前应先进行洗气除杂,一般选用饱和碳酸氢钠,洗气时,气体应长进短出,装置图为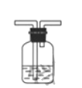 ;
;
(2)装置中含有空气,空气中的氧气可以将亚铁离子氧化为铁离子, CO2可将装置中的氧气排除,防止亚铁离子氧化;同时碳酸钠溶液碱性强,溶液中c(OH)大,就会出现生成氢氧化亚铁与制备的FeCO3成为竞争反应,而导致制备的FeCO3纯度低,NaHCO3溶液碱性弱,制得FeCO3纯度高,则先向1mol/L Na2CO3溶液中通入CO2的目的是排除装置中的空气,降低溶液中OH-的浓度,防止生成Fe(OH)2;
(3)乳酸中含有醇羟基,具有醇的性质,能被高锰酸鉀溶液氧化导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案





