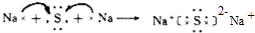题目内容
|
已知相同状况下,气体的体积之比等于气体的分子数之比.密闭容器中盛有氢气和氯气的混合气体,用电火花引爆后恢复到原状况,用足量NaOH溶液吸收后无气体剩余,原混合气体中氯气与氢气的体积比可能是 | |
A. |
大于1∶1 |
B. |
等于1∶1 |
C. |
小于1∶1 |
D. |
无法确定 |
答案:AB
提示:
提示:
|
本题考查的是Cl2与H2及NaOH的反应.当氢气和氯气的混合气体用电火花引爆时发生反应:H2+Cl2 若原混合气体中氯气与氢气的体积比V(Cl2)∶V(H2)=1∶1,则氢气和氯气恰好完全反应生成HCl,用足量NaOH溶液吸收后无气体剩余. 若原混合气体中V(Cl2)∶V(H2)<1∶1,用电火花引爆后氯气有剩余,由于Cl2+2NaOH 若原混合气体中V(Cl2)∶V(H2)<1∶1,用电火花引爆后氢气有剩余,氢气不能被NaOH溶液吸收,有气体剩余. |

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目