题目内容
【题目】[化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn2+的价电子排布图为___________。
(2)NO2的立体构型名称为___________,其中心原子的杂化方式为___________。
(3)写出和CN-互为等电子体的一种分子的电子式___________。
(4)铵盐大多易分解,NH4F和NH4Br两种盐中较难分解的是______(填化学式);理由是_______。
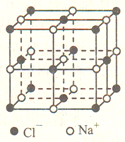
(5) 氧化亚铁晶胞与NaC1的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度ρ=___________________ g·cm-3 (列出计算式即可,用NA表示阿伏加德罗常数的值)。
【答案】![]() V型 SP2杂化
V型 SP2杂化 ![]() NH4Br Br-半径较大对H+吸引力较弱夺取NH4+中的H+较难
NH4Br Br-半径较大对H+吸引力较弱夺取NH4+中的H+较难 
【解析】
在氯化钠晶胞中,共含有4个“NaCl”,虽然氧化亚铁晶胞存在缺陷,但我们仍可利用氯化钠的晶胞进行类推,计算氧化亚铁晶胞的密度。
(1)基态Mn2+的价电子排布图为![]() ;
;
(2)NO2分子中的N原子除去连有2个O外,还有一对孤对电子,所以NO2的立体构型名称为V型,其中心原子的杂化方式SP2杂化;
(3)和CN-互为等电子体的一种分子,其必含2个原子,且价电子数为10,所以它可以是CO,也可以是N2,N2的电子式![]() ;
;
(4)铵盐大多易分解,判断分解的难易,可从产物的稳定性考虑。NH4F和NH4Br两种盐中较难分解的是NH4F;理由是Br-半径较大对H+吸引力较弱,夺取NH4+中的H+较难;
(5) 在Fe0.9O晶胞中,含有4个“Fe0.9O”,其中包含有Fe2+和Fe3+,晶胞边长为a pm,该晶体的密度ρ= g·cm-3。
g·cm-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案