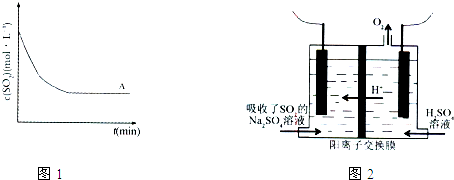
题目内容
2SO2(g)+ O2(g) 2SO3(g) △H = a kJ·mol-1,反应过程的能量变化如图所示。已知1mol
SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H = a kJ·mol-1,反应过程的能量变化如图所示。已知1mol
SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
(1)图中A点表示_______________________,a=__________ 。
(2) Ea的大小对该反应的△H _______(填“有” 或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
(3)已知单质硫的标准燃烧热为296kJ·mol-1,写出反应的热化学方程式:________________________ ____,常温常压下,由单质硫和氧气经两步反应,若生成1mol SO3(g),放出的总热量为___ ___ 。
(1)反应物总能量;-198;(2)无;减小;(3)S(s)+O2=SO2(g)△H=-296kJ•mol-1;-1185。
【解析】
试题分析:(1)因图中A表示反应物总能量;因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1。(2)因物质的活化能的大小与反应热无关;加入催化剂能降低物质的活化能,则Ea减小。(3)因燃烧热概念要求必须是lmol物质完全燃烧,则热化学方程式为:S(s)+O2=SO2(g)△H=-296kJ•mol-1;因单质硫的燃烧热为296KJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296KJ•mol-1,而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+1/2O2(g)=SO3(g)△H=-99kJ•mol-1,由盖斯定律可得:S(s)+3/2O2(g)=SO3(g)△H=-296KJ•mol-1+(-99kJ•mol-1)=-395KJ•mol-1,所以S(s)生成3molSO3(g)的△H为-395KJ•mol-1×3=-1185 KJ•mol-1。
考点:热化学方程式;吸热反应和放热反应;催化剂的作用。

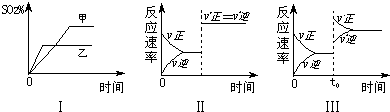
| A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 | B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响 | C、图Ⅱ表示t0时刻通入氦气对反应速率的影响 | D、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.