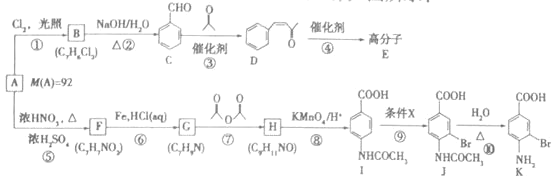
题目内容
【题目】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ/mol和-297kJ/mol,则CH4和SO2反应的热化学方程式为_______________。
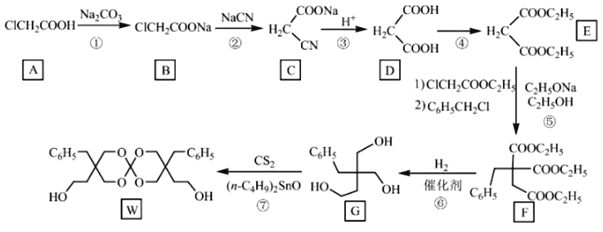
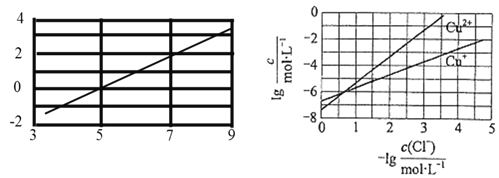
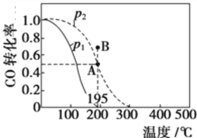
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
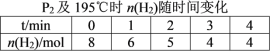
①P2及195℃下,在B点时,v(正)_____v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________0(填“>”、“<”或“=”),原因是______________________________。
③在0~2 min,平均反应速率v(H2)=______________________。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。
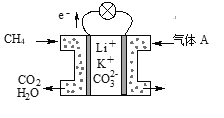
①气体A中除了O2外,一定还含有的气体是________。
②该电池的负极反应式为__________________________。
【答案】CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H= -296 kJ/mol < < 其他条件不变时,升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,说明逆反应方向为吸热,正反应方向放热 0.075 mol·L-1 ·min-1 ![]() CO2或二氧化碳 CH4-8e-+4CO32-=5CO2+2H2O
CO2或二氧化碳 CH4-8e-+4CO32-=5CO2+2H2O
【解析】
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol ①
S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol ②
将①-2×②即得CH4和SO2反应的热化学方程式。
(2)①在B点时,CO的转化率有向A转化的趋势,则由CO的转化率的变化,可推出平衡移动的方向,从而得出v(正)与v(逆)的关系。
②由图中数据可以看出,升高温度,CO的转化率减小,则可推出平衡移动的方向及ΔH。
③在0~2 min,平均反应速率v(H2)=![]() 。
。
④在P2及195 ℃时,三段式关系为:
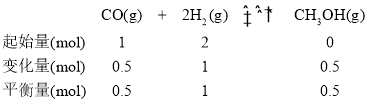
该反应的平衡常数Kp=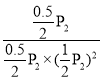 。
。
(3)①气体A中O2+4e-=2O2-,O2-最终将转化为CO32-,二者的差值为CO2。
②该电池的负极为CH4失电子,需要结合CO32-才能中和电性,生成CO2和H2O。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol ①
S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol ②
将①-2×②即得:CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H= -296 kJ/mol。答案为:CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H= -296 kJ/mol;
(2)①在B点时,CO的转化率有向A转化的趋势,则CO的转化率减小,平衡逆向移动,v(正)<v(逆)。答案为:<;
②升高温度,CO的转化率减小,平衡逆向移动,则该反应的ΔH<0,原因是其他条件不变时,升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,说明逆反应方向为吸热,正反应方向放热。答案为:<;其他条件不变时,升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,说明逆反应方向为吸热,正反应方向放热;
③在0~2 min,平均反应速率v(H2)=![]() =0.075 mol·L-1 ·min-1。答案为:0.075 mol·L-1 ·min-1;
=0.075 mol·L-1 ·min-1。答案为:0.075 mol·L-1 ·min-1;
④在P2及195 ℃时,三段式关系为:
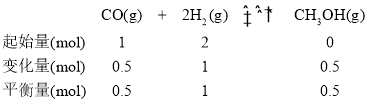
该反应的平衡常数Kp=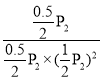 =
=![]() 。答案为:
。答案为:![]() ;
;
(3)①气体A中O2+4e-=2O2-,O2-最终将转化为CO32-,二者的差值为CO2,从而得出一定还含有的气体是CO2。答案为:CO2;
②该电池的负极为CH4失电子,需要结合CO32-才能中和电性,生成CO2和H2O,电极反应式为CH4-8e-+4CO32-=5CO2+2H2O。答案为:CH4-8e-+4CO32-=5CO2+2H2O。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案