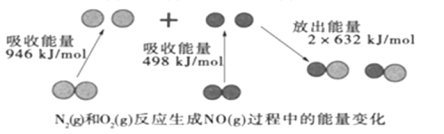
题目内容
【题目】(1)CH2Cl2的空间构型为______;聚丙烯的链节为______。
(2)比较Li+和H-半径大小r(Li+)____r(H-)(填“>”或“<”),并说明理由____。
【答案】四面体形  < Li+和H-的核外电子排布相同,Li+的核电荷数大于H-,电子层排布相同时核电荷数越大离子半径越小
< Li+和H-的核外电子排布相同,Li+的核电荷数大于H-,电子层排布相同时核电荷数越大离子半径越小
【解析】
(1) CH2Cl2中心C原子的价层电子对数=![]() ,孤电子对数=4-4=0,空间构型为四面体形;聚丙烯的链节是重复出现的结构片段,应为
,孤电子对数=4-4=0,空间构型为四面体形;聚丙烯的链节是重复出现的结构片段,应为 ,
,
故答案为:四面体形; ;
;
(2) Li+和H-的核外电子排布相同,Li+的核电荷数大于H-,电子层排布相同时核电荷数越大离子半径越小,因此锂离子的半径小于氢负离子半径,
故答案为:<;Li+和H-的核外电子排布相同,Li+的核电荷数大于H-,电子层排布相同时核电荷数越大离子半径越小

【题目】实验室铝热反应的实验装置如下:
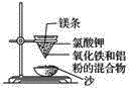
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液