题目内容
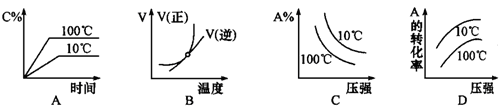
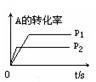
下列图像能正确地表达可逆反应3A(g)+B(g) 2C(g)(△H<0)的是
2C(g)(△H<0)的是
 2C(g)(△H<0)的是
2C(g)(△H<0)的是
D
试题分析:对于可逆反应3A(g)+B(g)
 2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
 2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1

 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: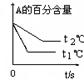
 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 

 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
 2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是

 CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下: Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ