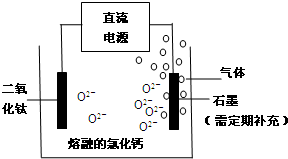
题目内容
13.工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外.还含有少量NH4+、Fe3+、AsO43-、Cl-.为除去杂质离子,部分操作流程如下: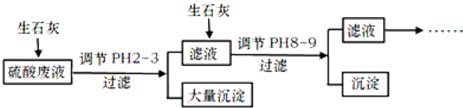
请回答问题:
(1)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]<c(NH4Cl)(填:<、=或>).
(2)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中$\frac{[N{H}_{3}•{H}_{2}O]}{[O{H}^{-}]}$减小(填“增大”、“减小”或“不变”).
(3)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],提纯CaSO4•2H2O的主要步骤:向沉淀中加入过量稀硫酸,充分反应后,过滤、洗涤、晾干或干燥.
(4)25℃,H3AsO4电离常数为K1=5.6×10-3、K2=1.7×10-7、K3=4.0×10-12.当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2 才开始沉淀的原因是H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀.
②Na3AsO4第一步水解的平衡常数数值为2.5×10-3.
③已知:AsO43-+2I-+2H+═AsO43-+I2+H2O,SO2+I2+2H2O═SO42-+2I-+4H+.上述两个反应中还原性最强的微粒是SO2.
分析 硫酸废液中含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,调节pH2~3,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl,
(1)根据c(NH4+)越大,NH4+水解程度越小判断;
(2)随着向废液中投入生石灰,c(OH-)增大,c(NH3•H2O)减小;
(3)提纯CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,并洗涤、干燥;
(4)①H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀;
②依据水解常数与电离常数及Kw的关系计算;
③根据还原剂还原性大于还原产物的还原性判断.
解答 解:硫酸废液中含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,调节pH2~3,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl,
(1)如c[(NH4)2SO4]=c(NH4Cl),则(NH4)2SO4溶液中c(NH4+)较大,因c(NH4+)越大,NH4+水解程度越小,则(NH4)2SO4溶液中c(NH4+)小于是NH4Cl溶液中c(NH4+)的2倍,如等于2倍,则c(NH4Cl)应较大,
故答案为:<;
(2)随着向废液中投入生石灰,c(OH-)增大,c(NH3•H2O)减小,则溶液中 $\frac{[NH{\;}_{3}•H{\;}_{2}O]}{[OH{\;}^{-}]}$减小,故答案为:减小;
(3)提纯CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4•2H2O的溶解,过滤后洗涤、干燥,故答案为:稀硫酸;晾干或干燥;
(4)①H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀;
②Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O?HAsO42-+OH-,该步水解的平衡常数Kh=$\frac{c(HAsO{\;}_{4}{\;}^{2-})•c(OH{\;}^{-})}{c(AsO{\;}_{4}{\;}^{3-})}$=$\frac{c(HAs{{O}_{4}}^{2-})•c(O{H}^{-})•c({H}^{+})}{c(AsO{{\;}_{4}}^{3-})•c({H}^{+})}$=$\frac{K{\;}_{w}}{K{\;}_{3}}$=$\frac{10{\;}^{-14}}{4.0×10{\;}^{-12}}$=2.5×10-3,
故答案为:2.5×10-3;
③已知:AsO43-+2I-+2H+=AsO33-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.还原剂还原性大于还原产物的还原性,则还原性SO2>I->AsO33-,两个反应中还原性最强的微粒是SO2,
故答案为:SO2.
点评 本题考查较为综合,侧重于学生的分析、实验和计算能力的考查,注意把握溶液中浓度的换算,沉淀溶解平衡的溶度积常数计算,水解常数和电离常数的计算,离子方程式的书写,沉淀的形成等,考查的知识点较多,题目难度中等.

| A. | NH4+、SO42-、CO32-、K+ | B. | Na+、Ba2+、Ca2+、HCO3- | ||
| C. | Mg2+、Ag+、K+、Cl- | D. | K+、Cl-、Na+、SO42- |
 可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )| A. | A和B可能都是固体 | B. | A和B一定都是气体 | ||
| C. | 若B为固体,则A一定是气体 | D. | A和B不可能都是气体 |
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 铁在潮湿的空气中生锈 | D. | 铝遇到冷的浓硝酸溶液发生钝化 |
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.